题目内容
15. 乙酰苯胺是常用的医药中间体,可由苯胺与乙酸制备.反应的化学方程式如下:
乙酰苯胺是常用的医药中间体,可由苯胺与乙酸制备.反应的化学方程式如下: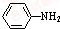 (苯胺)+CH3COOH?
(苯胺)+CH3COOH? (乙酸苯胺)+H2O
(乙酸苯胺)+H2O有关化合物的物理性质见下表:
| 化合物 | 密度(g.cm-3) | 溶解性 | 熔点(℃) | 沸点(℃) |
| 乙酸 | 1.05 | 易溶于水、乙醇 | 17 | 118 |
| 苯胺 | 1.02 | 微溶于水,易溶于乙醇 | -6 | 184 |
| 乙酰苯胺 | - | 微溶于冷水,可溶于热水,易溶于乙醇 | 114 | 304 |
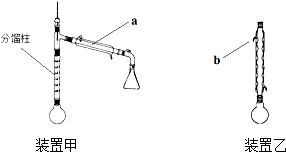
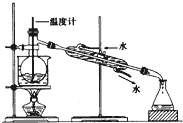
方案甲:采用装置甲(分馏柱的作用类似于石油分馏中的分馏塔).在圆底烧瓶中加入5.0mL 苯胺、7.4mL乙酸,加热至沸,控制温度计读数100~105℃,保持液体平缓流出,反应40min后停止加热.将圆底烧瓶中的液体趁热倒入盛有100mL水的烧杯,冷却后有乙酰苯胺固体析出,过滤得粗产物.
方案乙:采用装置乙,加热回流,反应40min后停止加热.其余与方案甲相同.
提纯:
甲乙两方案均采用重结晶方法.操作如下:
①加热溶解→②活性炭脱色→③趁热过滤→④冷却结晶→⑤过滤→⑥洗涤→⑦干燥
请回答:
(1)仪器a的名称是冷凝管,b处水流方向是出水(填“进水”或“出水”).
(2)合成步骤中,乙酰苯胺固体析出后,过滤分离出粗产物.留在滤液中的主要物质是乙酸.
(3)提纯过程中的第③步,过滤要趁热的理由是防止温度降低导致乙酰苯胺析出,降低产率.
(4)提纯过程第⑥步洗涤,下列洗涤剂中最合适的是A.
A.蒸馏水 B.乙醇 C.5%Na2CO3溶液 D.饱和NaCl溶液
(5)从投料量分析,为提高乙酰苯胺产率,甲乙两种方案均采取的措施是乙酸过量;实验结果表明方案甲的产率较高,原因是方案甲将反应过程中生成的水蒸出,促进反应.
分析 (1)根据仪器的结构特征,仪器a的名称是冷凝管;应使整个冷凝管通入冷凝水,充分冷却;
(2)在圆底烧瓶中加入了5.0 mL 苯胺、7.4 mL乙酸,根据化学反应和表格提供的信息可知,乙酸过量,所以留在滤液中的主要物质是乙酸;
(3)趁热过滤,防止温度降低导致乙酰苯胺析出,降低产率;
(4)乙酰苯胺微溶于冷水,可溶于热水,易溶于乙醇,所以洗涤乙酰苯胺时,最合适的试剂是蒸馏水;
(5)从投料量来看,为提高乙酰苯胺产率,甲乙两种方案均加入的乙酸过量;方案甲将反应过程中生成的水蒸出,促进反应进行.
解答 解:(1)根据仪器的结构特征,仪器a的名称是冷凝管;应使整个冷凝管通入冷凝水,充分冷却,即由下口通入,由上口流出,b处水流方向是出水,
故答案为:冷凝管;出水;
(2)在圆底烧瓶中加入了5.0 mL 苯胺、7.4 mL乙酸,苯胺完全反应消耗乙酸为$\frac{5mL×1.02g/mL}{93g/mol}$×60g/mol=3.29g<7.4mL×1.05g/mL=7.77g,故乙酸过量,所以留在滤液中的主要物质是乙酸,
故答案为:乙酸;
(3)为了防止温度降低导致乙酰苯胺析出,降低产率,所以过滤要趁热,
故答案为:防止温度降低导致乙酰苯胺析出,降低产率;
(4)乙酰苯胺微溶于冷水,可溶于热水,易溶于乙醇,所以洗涤乙酰苯胺时,最合适的试剂是蒸馏水,
故答案为:A;
(5)从投料量来看,为提高乙酰苯胺产率,甲乙两种方案均加入的乙酸过量;两种方案相比,方案甲将反应过程中生成的水蒸出,促进反应进行,导致方案甲的产率较高,
故答案为:乙酸过量;方案甲将反应过程中生成的水蒸出,促进反应.
点评 本题考查有机物制备实验方案设计、基本实验操作、反应条件控制以及产率问题等知识,注意对题目信息的应用,在制备实验中注意提高原料利用率或产物产率,难度中等.


| A. | a中盛浓盐酸,b中盛浓硫酸 | B. | a中盛浓硫酸,b中盛固体氯化铵 | ||
| C. | f中盛固体氯化钠和浓硫酸 | D. | f中盛固体氯化铵 |
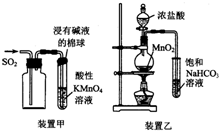
| A. | 用装置甲收集SO2并验证其漂白性 | |
| B. | 用装置乙验证氯气与水反应有盐酸生成 | |
| C. | 用澄清石灰水鉴别苏打溶液和小苏打溶液 | |
| D. | 用NaOH溶液除去苯中混有的少量苯酚,反应后分液 |
| A. | 用蘸有浓氨水的棉棒检验输送氯气的管道是否漏气 | |
| B. | 用合成聚碳酸酯可降解塑料,实现“碳”的循环利用 | |
| C. | 大力实施矿物燃料脱硫脱硝技术,能减少二氧化硫、氮氧化物的排放 | |
| D. | 向工业生产的反应中加入合适的催化剂,能改变反应的焓变 |

查阅资料得知:
i.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO42-.
ii.
| 物质 | 开始沉淀的pH值 | 完全沉淀的pH值 |
| Fe(OH)3 | 2.7 | 3.7 |
| Al(OH)3 | 3.4 | 4.4 |
| Cr (OH)3 | 4.6 | 5.9 |
| Fe(OH)2 | 7.5 | 9.7 |
| Bi(OH)3 | 0.7 | 4.5 |
(1)反应之前先将矿石粉碎的目的是增大反应物的接触面积,加快反应速率.
(2)操作Ⅰ、Ⅲ、Ⅳ用到的主要玻璃仪器有玻璃棒和漏斗、烧杯(填仪器名称).
(3)写出④反应的离子反应方程式3NaBiO3+2Cr3++7OH-+H2O=2CrO42-+3Na++3Bi(OH)3.
(4)⑤中酸化是使CrO42-转化为Cr2O72-,写出该反应的离子方程式2CrO42-+2H+?Cr2O72-+H2O.
(5)将溶液H经过下列操作,蒸发浓缩,冷却结晶,过滤,洗涤,干燥即得红矾钠.
(6)取一定质量的固体D溶解于200mL的硫酸中,向所得溶液中加入5mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V关系如图所示,则硫酸的浓度为2.5mol•L-1;,固体D中含Fe化合物的物质的量为0.1mol.

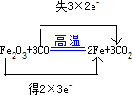 .
.
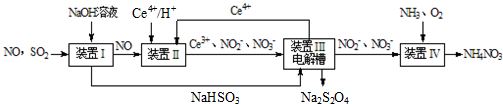
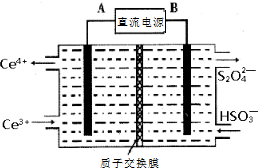
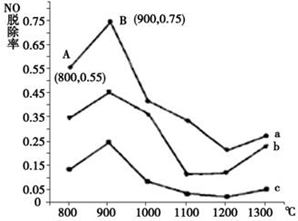 硫、氮氧化物是形成酸雨、雾霾等环境污染的罪魁祸首,采用合适的措施消除其污染是保护环境的重要举措.
硫、氮氧化物是形成酸雨、雾霾等环境污染的罪魁祸首,采用合适的措施消除其污染是保护环境的重要举措.