题目内容
16.下列叙述正确的是( )| A. | 生铁中含有碳,抗腐蚀能力比纯铁强 | |
| B. | 钢铁发生析氢腐蚀时,负极反应是:Fe-3e-═Fe3+ | |
| C. | 在铁制品上镀铜时,镀件为阳极,铜盐为电镀液 | |
| D. | 铁管上镶嵌锌块,铁管不易被腐蚀 |
分析 A、生铁中含有杂质,更容易发生电化学腐蚀;
B、钢铁发生析氢腐蚀时,铁失电子生成亚铁离子而作负极;
C、在电镀时,要将需要溶解的做阳极;
D、在铁管上镶嵌锌块,形成原电池.
解答 解:A、生铁中含有杂质,更容易发生电化学腐蚀,因此生铁更易腐蚀,故A错误;
B、钢铁发生析氢腐蚀时,铁失电子生成亚铁离子而作负极,电极反应式为:Fe-2e-=Fe2+,故B错误;
C、在铁制品上镀铜时,镀层金属铜为阳极,镀件铁制品为阴极,铜盐为电镀液,故C错误;
D、在铁管上镶嵌锌块,形成原电池,锌做负极,铁做正极被保护,故不易被腐蚀,故D正确.
故选D.
点评 本题考查了金属的腐蚀与防护,明确原电池和电解池原理是解本题关键,再结合各个电极上发生的反应来确定金属被保护还是被腐蚀,易错选项是B,注意金属的电化学腐蚀中,铁生成亚铁离子而不是铁离子,为易错点.

练习册系列答案
相关题目
19.下列说法正确的是( )
| A. | 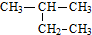 与 与 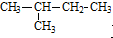 互为同分异构体 互为同分异构体 | |
| B. | 红磷与白磷互为同素异形体 | |
| C. | CH3CH2OH与HOCH2CH2CH2OH互为同系物 | |
| D. | 35Cl与37Cl为同一种核素 |
7.氢能是一种洁净的可再生能源,制备和储存氢气是氢能开发的两个关键环节.
Ⅰ氢气的制取
(1)水是制取氢气的常见原料,下列说法正确的是AB(填序号).
A.H3O+的空间构型为三角锥形
B.水的沸点比硫化氢高
C.冰晶体中,1mol水分子可形成4mol氢键
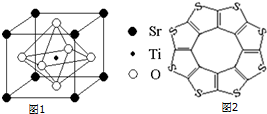
(2)科研人员研究出以钛酸锶为电极的光化学电池,用紫外线照射钛酸锶电极,使水分解产生氢气.已知钛酸锶晶胞结构如图1,则其化学式为SrTiO3.
Ⅱ氢气的存储
(3)Ti(BH4)2是一种储氢材料.
①Ti原子在基态时的核外电子排布式是1s22s22p63s23p63d24s2或[Ar]3d24s2.
②Ti(BH4)2可由TiCl4和LiBH4反应制得,TiCl4 熔点-25.0℃,沸点136.94℃,常温下是无色液体,则TiCl4晶体类型为分子晶体.
(4)最近尼赫鲁先进科学研究中心借助ADF软件对一种新型环烯类储氢材料(C16S8)进行研究,从理论角度证明这种分子中的原子都处于同一平面上(结构如图2所示),每个平面上下两侧最多可储存10个H2分子.
①元素电负性大小关系是:C<S(填“>”、“=”或“<”).
②分子中C原子的杂化轨道类型为sp2.
③有关键长数据如下:
从表中数据可以看出,C16S8中碳硫键键长介于C-S与C═S之间,原因可能是:分子中的C与S原子之间有π键或分子中的碳硫键具有一定程度的双键性质.
④C16S8与H2微粒间的作用力是范德华力.
Ⅰ氢气的制取
(1)水是制取氢气的常见原料,下列说法正确的是AB(填序号).
A.H3O+的空间构型为三角锥形
B.水的沸点比硫化氢高
C.冰晶体中,1mol水分子可形成4mol氢键
(2)科研人员研究出以钛酸锶为电极的光化学电池,用紫外线照射钛酸锶电极,使水分解产生氢气.已知钛酸锶晶胞结构如图1,则其化学式为SrTiO3.

Ⅱ氢气的存储
(3)Ti(BH4)2是一种储氢材料.
①Ti原子在基态时的核外电子排布式是1s22s22p63s23p63d24s2或[Ar]3d24s2.
②Ti(BH4)2可由TiCl4和LiBH4反应制得,TiCl4 熔点-25.0℃,沸点136.94℃,常温下是无色液体,则TiCl4晶体类型为分子晶体.
(4)最近尼赫鲁先进科学研究中心借助ADF软件对一种新型环烯类储氢材料(C16S8)进行研究,从理论角度证明这种分子中的原子都处于同一平面上(结构如图2所示),每个平面上下两侧最多可储存10个H2分子.
①元素电负性大小关系是:C<S(填“>”、“=”或“<”).
②分子中C原子的杂化轨道类型为sp2.
③有关键长数据如下:
| C-S | C═S | C16S8中碳硫键 | |
| 键长/pm | 181 | 155 | 176 |
④C16S8与H2微粒间的作用力是范德华力.
4.下列说法不合理的是( )
| A. | 在稀硫酸中加入铜粉,铜粉不溶解,若加入KNO3固体,铜粉溶解 | |
| B. | “溶洞”的形成过程中发生了碳酸钙与水、CO2的反应 | |
| C. | 采用催化转化技术可以将汽车尾气中的氮氧化物CO转化为无毒气体 | |
| D. | FeCl3、Na2O2、CuS均可由相应的单质直接化合而成 |
11.下列实验能达到目的是( )
| A. | 加入盐酸以除去硫酸钠中少量的碳酸钠杂质 | |
| B. | 用玻璃棒搅拌漏斗中的液体以加快反应速率 | |
| C. | 用稀硫酸和锌反应制氢气时加入少许硫酸铜以加快反应速率 | |
| D. | 在容量瓶中加入一定体积的水,再加入浓硫酸配制准确浓度的稀硫酸 |
1.下列反应属于取代反应的是( )
| A. | 苯与溴水混合振荡,溴水层的颜色变浅 | |
| B. | 乙烯通入酸性KMnO4溶液中,溶液的紫色褪去 | |
| C. | 乙酸与乙醇在浓硫酸作用下共热反应生成乙酸乙酯 | |
| D. | 苯与氯气在一定条件下反应生成六六六(化学式C6H6Cl6) |
8.下列实验操作和数据记录都正确的是( )
| A. | 用托盘天平称量时,将NaOH固体放在左盘内的纸上,称得质量为10.2 g | |
| B. | 用25 mL碱式滴定管量取高锰酸钾溶液,体积为16.60 mL | |
| C. | 用广泛pH试纸测稀盐酸的pH=3.2 | |
| D. | 用10 mL量筒量取NaCl溶液,体积为9.2 mL |
5.对于图象①→④的辨析正确的是( )
| A. |  表示反应A(g)+B(g)→C(g)+D(g)是吸热反应,吸收能量(E2-E1)kJ | |
| B. |  为氢氧燃料电池示意图,正、负极通入的气体体积之比为2:1 | |
| C. |  是物质a、b的溶解度曲线,可以用重结晶法从a、b混合物中提纯a | |
| D. |  可表示压强对反应2A(g)+B(g)?3C(g)+D(s)的影响,且乙的压强大 |
6.下列物质的变化中,发生了氧化反应的是( )
| A. | MnO4-→Mn2+ | B. | H2S→SO2 | C. | CuO→Cu | D. | Fe3+→Fe2+ |