题目内容
18.25℃时,10L水中含有OH-的物质的量为10-6mol,含H+的个数为10-6NA个(设阿伏加德罗常数为NA,下同).1g水中含H+的个数为10-10NA个.分析 25℃时,c(OH-)=c(H+)=10-7mol/L,结合N=nNA、V=$\frac{m}{ρ}$计算.
解答 解:25℃时,c(OH-)=c(H+)=10-7mol/L,10L水中含有OH-的物质的量为10L×10-7mol/L=10-6mol,含H+的个数为10-6mol×NA=10-6NA个,1g水的体积为1mL,则1g水中含H+的个数为1mL×10-3L×10-7mol/L×NA=10-10NA,
故答案为:10-6;10-6NA;10-10NA.
点评 本题考查物质的量的计算,为高频考点,把握常温下c(OH-)=c(H+)=10-7mol/L为解答的关键,侧重分析与计算能力的考查,注意基本计算公式的应用,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.某炼金厂的废水因连降暴雨而溢出,导致河水严重污染,炼金废水中所含CN-有剧毒,其性质与卤素离子相似,还原性介于I-与Br-之间,HCN为弱酸.下列说法不正确的是( )
| A. | CN-可以和稀硫酸反应生成HCN | B. | CN-可被Cl2氧化成(CN)2 | ||
| C. | 在水溶液中(CN)2不能将F-氧化 | D. | HCN的电子式为 |
9.下列关于原电池和电解池的区别与联系的说法中,不正确的是( )
| A. | 原电池是将化学能转化为电能的装置,而电解池是将电能转化为化学能的装置 | |
| B. | 电解池的形成条件中要求必须有电源,原电池的形成条件中不要求有电源 | |
| C. | 原电池的负极和电解池的阴极发生的反应类型一样,都是氧化反应 | |
| D. | 原电池的正极和电解池的阴极都是电子流入的一极 |
6.下列关于有机化合物的说法正确的是( )
| A. | 人体呼出的气体中含有CO2,绿色植物的光合作用吸收CO2,CO2是一种有机化合物 | |
| B. | 水是生命之源,H2O是一种有机化合物 | |
| C. | 绝大多数的含碳物质是有机化合物 | |
| D. | 有机化合物可以转化为无机化合物 |
13.氟氧酸(HOF)是唯一可分离出固态的“次卤酸”,具有爆炸性,其中氟原子的质子数为氢原子和氧原子的质子数之和.若agHOF中所含质子数与13.44L际准状况下CH4所含质子数相等,则a的值为( )
| A. | 6 | B. | 12 | C. | 18 | D. | 24 |
4.下列反应的离子方程式错误的是( )
| A. | 稀硝酸和过量铁屑反应:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| B. | 氯化铝溶液和过量的氨水反应:Al3++4NH3•H2O═Al2-+4NH4++2H2O | |
| C. | 碳酸钠溶液中加入过量苯酚: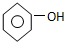 +CO32-→ +CO32-→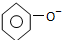 +HCO3- +HCO3- | |
| D. | 次氯酸钙溶液中通入过量CO2:ClO-+CO2+H2O═HClO+HCO3- |
1.某有机物的结构简式如图,关于该物质的叙述错误的是( )
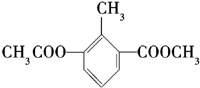

| A. | 一个分子中含有12个H原子 | B. | 苯环上的一氯代物有2种 | ||
| C. | 含有一种含氧官能团 | D. | 分子式是C11H12O4 |
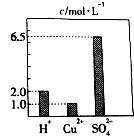 在0.2L由H2SO4、CuSO4和Al2(SO4)3组成的混合溶液中,部分离子浓度大小如图所示,请回答下列问题:
在0.2L由H2SO4、CuSO4和Al2(SO4)3组成的混合溶液中,部分离子浓度大小如图所示,请回答下列问题: