题目内容
9.下列关于原电池和电解池的区别与联系的说法中,不正确的是( )| A. | 原电池是将化学能转化为电能的装置,而电解池是将电能转化为化学能的装置 | |
| B. | 电解池的形成条件中要求必须有电源,原电池的形成条件中不要求有电源 | |
| C. | 原电池的负极和电解池的阴极发生的反应类型一样,都是氧化反应 | |
| D. | 原电池的正极和电解池的阴极都是电子流入的一极 |
分析 A.原电池是将化学能转化为电能,电解是将电能转化为化学能;
B.电解池是非自发进行的氧化还原反应,原电池是自发进行的氧化还原反应;
C.原电池负极失电子,电解池阴极得电子;
D.原电池中电子从正极流入,电解池中电子从阴极流入.
解答 解:A.原电池是将化学能转化为电能的装置,电解是将电能转化为化学能的装置,故A正确;
B.电解池是非自发进行的氧化还原反应,要外加电源,原电池是自发进行的氧化还原反应,不需要外加电源,故B正确;
C.原电池负极失电子发生氧化反应,电解池中阴极得电子发生还原反应,故C错误;
D.原电池中电子从负极流出经导线流入正极,电解池中电子从外加电源的负极流出经导线流入阴极,阴极得电子,故D正确.
故选C.
点评 本题考查原电池、电解池工作原理,比较基础,注意对基础知识的理解掌握,侧重于电极的判断、能量转化、电子移动等内容的考查.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
20.设NA是阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 含4molHCl的浓盐酸与足量MnO2混合加热,产生NA个Cl2 | |
| B. | 氧气和臭氧组成的4.8g混合气体中含有0.3 NA个氧原子 | |
| C. | 标准状况下,2.24L SO3含有分子的数目为0.1NA | |
| D. | 1mol 硫酸氢钠溶液中含有阳离子数为NA |
1.《汉书》中“高奴县有洧水可燃”,沈括在《梦溪笔谈》对从地表渗出的、当地人称为“石脂”或“洧水”的使用有“予知其烟可用,试扫其烟为墨,黑光如漆,松墨不及也,此物必大行于世”的描述,关于上文的下列说法中正确的是( )
| A. | “洧水”的主要成分是油脂 | B. | “洧水”的主要成分是煤油 | ||
| C. | “洧水”的主要成分是石油 | D. | 其烟的主要成分是石墨 |
13.配制一定体积、一定物质的量浓度的溶液,对实验结果产生偏低影响的是( )
| A. | 容量瓶中原有少量蒸馏水 | |
| B. | 溶液未冷却至室温就转移到容量瓶中定容 | |
| C. | 定容时仰视观察液面 | |
| D. | 定容时俯视观察液面 |
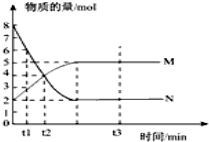 一定温度下,在容积为VL的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图示.
一定温度下,在容积为VL的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图示.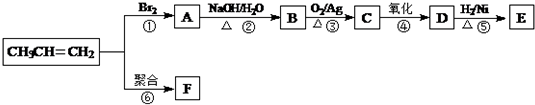
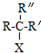 $\stackrel{NaOH/H_{2}O}{→}$
$\stackrel{NaOH/H_{2}O}{→}$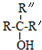 (X为卤素原子,R,R′,R″均为烃基或H原子)
(X为卤素原子,R,R′,R″均为烃基或H原子)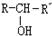 $\stackrel{O_{2}/Ag}{→}$
$\stackrel{O_{2}/Ag}{→}$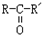 ,
,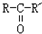 $\stackrel{H_{2}/Ni}{→}$
$\stackrel{H_{2}/Ni}{→}$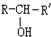
 ; D的结构简式是O=C(CH3)COOH.
; D的结构简式是O=C(CH3)COOH. .
.