题目内容
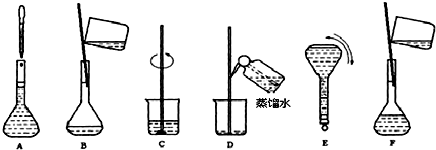
某同学按下列步骤配制500ml 0.2mol.L-1KCl溶液,请回答有关问题.
(1)上述实验中使用容量瓶前应检验 .
(2)若进行⑤步骤时加蒸馏水超过刻度线,则需 .
(3)取出该KCl溶液10ml加水稀释到100ml,稀释后溶液中KCl的物质的量浓度是 .
| 实验步骤 | 有关问题 |
| ①计算所需KCl的质量 | 需要称量KCl的质量为 |
| ②称量KCl固体 | 称量需要用到的主要仪器是: |
| ③将KCl加入100ml烧杯中,并加入适量水 | |
| ④将烧杯中溶液转移至500ml容量瓶中 | |
| ⑤向容量瓶中加蒸馏水至刻度线 | 在进行此操作时当加水至刻度线1-2cm处应如何操作: |
(2)若进行⑤步骤时加蒸馏水超过刻度线,则需
(3)取出该KCl溶液10ml加水稀释到100ml,稀释后溶液中KCl的物质的量浓度是
考点:配制一定物质的量浓度的溶液
专题:
分析:依据n=VC,m=nM计算溶质的质量;
称量固体一般用托盘天平,用药匙取药品;
依据固体溶解的正确操作方法解答;
移液时,应保证烧杯中所有溶质都转移到容量瓶中,注意洗涤烧杯和玻璃棒;
依据定容的正确操作解答;
(1)容量瓶带有塞子,使用过程中需要上下颠倒,使用前应注意检查是否漏水;
(2)不当操作导致实验失败,必须重新配制;
(3)依据稀释前后溶液中所含溶质的物质的量不变计算.
称量固体一般用托盘天平,用药匙取药品;
依据固体溶解的正确操作方法解答;
移液时,应保证烧杯中所有溶质都转移到容量瓶中,注意洗涤烧杯和玻璃棒;
依据定容的正确操作解答;
(1)容量瓶带有塞子,使用过程中需要上下颠倒,使用前应注意检查是否漏水;
(2)不当操作导致实验失败,必须重新配制;
(3)依据稀释前后溶液中所含溶质的物质的量不变计算.
解答:
解:①配制500ml 0.2mol.L-1KCl溶液,需要氯化钾的物质的量=0.5L×0.2mol.L-1=0.1mol,其质量m=0.1mol×74.5g/mol=7.5g,故答案为:7.5;
②实验室用托盘天平称量KCl固体,用药匙取药品,故答案为:托盘天平和药匙;
③将KCl加入100ml烧杯中,并加入适量水,用玻璃杯搅拌加速氯化钾的溶解速率,故答案为:用玻璃杯搅拌加速氯化钾的溶解速率;
④用玻璃棒引流将将烧杯中溶液转移至500ml容量瓶中,并洗涤烧杯和玻璃棒,洗涤液转移的容量瓶中,故答案为:用玻璃棒引流,并洗涤烧杯和玻璃棒,洗涤液转移的容量瓶中;
⑤向容量瓶中加蒸馏水至离刻度线1-2cm时,改用胶头滴管逐滴滴加,到凹液面最低处与刻度线相切,故答案为:改用胶头滴管逐滴滴加,到凹液面最低处与刻度线相切;
(1)容量瓶带有塞子,使用过程中需要上下颠倒,使用前应注意检查是否漏水,故答案为:是否漏水;
(2)若进行⑤步骤时加蒸馏水超过刻度线,实验失败,必须重新配制,故答案为:重新配制;
(3)依据稀释前后溶液中所含溶质的物质的量不变,设稀释后溶液中KCl的物质的量浓度为c,则:10ml×0.2mol.L-1=100ml×c,解得c=0.02mol/L,
故答案为:0.02mol/L.
②实验室用托盘天平称量KCl固体,用药匙取药品,故答案为:托盘天平和药匙;
③将KCl加入100ml烧杯中,并加入适量水,用玻璃杯搅拌加速氯化钾的溶解速率,故答案为:用玻璃杯搅拌加速氯化钾的溶解速率;
④用玻璃棒引流将将烧杯中溶液转移至500ml容量瓶中,并洗涤烧杯和玻璃棒,洗涤液转移的容量瓶中,故答案为:用玻璃棒引流,并洗涤烧杯和玻璃棒,洗涤液转移的容量瓶中;
⑤向容量瓶中加蒸馏水至离刻度线1-2cm时,改用胶头滴管逐滴滴加,到凹液面最低处与刻度线相切,故答案为:改用胶头滴管逐滴滴加,到凹液面最低处与刻度线相切;
(1)容量瓶带有塞子,使用过程中需要上下颠倒,使用前应注意检查是否漏水,故答案为:是否漏水;
(2)若进行⑤步骤时加蒸馏水超过刻度线,实验失败,必须重新配制,故答案为:重新配制;
(3)依据稀释前后溶液中所含溶质的物质的量不变,设稀释后溶液中KCl的物质的量浓度为c,则:10ml×0.2mol.L-1=100ml×c,解得c=0.02mol/L,
故答案为:0.02mol/L.
点评:本题考查了配制一定物质的量浓度溶液,明确配制过程和原理是解题关键,注意仪器的使用方法和误差分析的技巧,题目难度不大.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
在同温同压下,8.25g气体X所占体积与6gO2的体积相同,则X的相对分子质量是( )
| A、22 | B、28 | C、44 | D、88 |
1.9g AO32-中核外电子数比质子数多3.01×1022个,则元素A的相对原子质量为( )
| A、12 | B、28 | C、32 | D、76 |
如图曲线a和b是盐酸与氢氧化钠的相互滴定的滴定曲线,下列叙述正确的是( )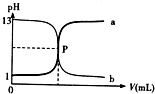

| A、P 点时反应恰好完全中和,溶液呈中性 |
| B、盐酸的物质的量浓度为1mol/L |
| C、曲线a是盐酸滴定氢氧化钠的滴定曲线 |
| D、酚酞不能用做本实验的指示剂 |
部分弱酸的电离平衡常数如下表:下列说法正确的是( )
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | K=1.77×10-4 | K=4.9×10-10 | K1=4.2×10-7 K2=5.6×10-11 |
| A、0.1mol?L-1NaHCO3溶液中浓度的大小:c(Na+)>c(HCO 3-)>c(H+)>c(OH-) |
| B、少量的CO2通入到NaCN溶液中 CN-+H2O+CO2=HCN+HCO 3- |
| C、用0.1mol?L-1NaOH溶液中和等浓度的HCN和HCOOH时前者所需NaOH溶液体积大 |
| D、0.1mol?L-1HCOONa溶液比0.1mol?L-1NaCN溶液所含离子总数小 |
一水合氨是一种常见的弱碱,为了证明一水合氨是弱电解质.,某同学开展了题为“一水合氨是弱电解质的实验研究”的探究活动.该同学设计了如下方案,其中错误的是( )
| A、先配制一定量的0.10mol?L-1氨水,然后测溶液的pH,若pH小于13,则可证明一水合氨为弱电解质. |
| B、先分别配制一定量0.01mol?L-1氨水和0.10mol?L-1氨水,分别用pH计测它们的pH,若两者的pH相差小于1个单位,则可证明一水合氨是弱电解质. |
| C、先测0.10mol?L-1 氨水的pH,然后将其加热至100℃,再测pH,如果pH变大则可证明一水合氨是弱电解质. |
| D、配制一定量的NH4Cl溶液.测pH.若常温下pH小于7.则证明一水合氨是弱电解质. |
 浙江省“五水共治”是水质治理的重要举措,其中化学需氧量(COD)是水质测定中的重要指标,可以反映水中有机物等还原剂的污染程度.COD是指在一定条件下,用强氧化剂氧化水样中的还原剂及有机物时所消耗氧化剂的量,然后折算成氧化水样中的这些还原剂及有机物时需要氧气的量.某学习小组用重铬酸钾法测定某水样中的COD.主要的实验装置、仪器及具体操作步骤如下:实验装置及仪器:
浙江省“五水共治”是水质治理的重要举措,其中化学需氧量(COD)是水质测定中的重要指标,可以反映水中有机物等还原剂的污染程度.COD是指在一定条件下,用强氧化剂氧化水样中的还原剂及有机物时所消耗氧化剂的量,然后折算成氧化水样中的这些还原剂及有机物时需要氧气的量.某学习小组用重铬酸钾法测定某水样中的COD.主要的实验装置、仪器及具体操作步骤如下:实验装置及仪器: