题目内容
12.下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )| 选项 | 实验 | 现象 | 结论 |
| A | 用pH试纸检测:0.1mol•L-1Na2SO3溶液、0.1mol•L-1NaHSO3溶液 | Na2SO3溶液的pH约为10; NaHSO3溶液的pH约为5 | HSO3-结合H+的能力比SO32-强 |
| B | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 溶液红色变浅 | Na2CO3溶液中存在水解平衡 |
| C | 注射器中吸入NO2,封堵针尖处,将注射器体积压缩为原来的一半 | 气体颜色比起始时浅 | 加压后,NO2转变为无色的N2O4 |
| D | 饱和BaSO4悬浊液中加入饱和Na2CO3溶液,振荡,然后过滤、洗涤,向所得固体中加入盐酸 | 沉淀部分溶解且有气体产生 | Ksp(BaSO4)> Ksp(BaCO3) |
| A. | A | B. | B | C. | C | D. | D |
分析 A.阴离子水解程度越大,溶液pH越大,说明越易结合氢离子;
B.加入少量BaCl2固体,生成碳酸钡沉淀,水解平衡逆向移动;
C.通过减小体积来增大压强,平衡向气体体积减小的方向移动,但反应物的浓度仍然大于原来浓度;
D.c(Ba2+)c(CO32-)>Ksp(BaCO3),有BaCO3沉淀生成.
解答 解:A.阴离子水解程度越大,溶液pH越大,说明越易结合氢离子,则HSO3-结合H+的能力比SO32-的弱,故A错误;
B.加入少量BaCl2固体,生成碳酸钡沉淀,水解平衡逆向移动,溶液红色变浅,故B正确;
C.通过减小体积来增大压强,平衡向气体体积减小的方向移动,但反应物的浓度仍然大于原来浓度,所以该反应中二氧化氮浓度大于原来浓度,所以气体颜色比起始时深,故C错误;
D.饱和BaSO4悬浊液中加入饱和Na2CO3溶液,c(Ba2+)c(CO32-)>Ksp(BaCO3),有BaCO3沉淀生成,不能说明Ksp(BaCO3)、Ksp(BaSO4)的关系,故D错误;
故选B.
点评 本题考查化学实验方案评价,为高频考点,侧重考查学生实验探究、实验判断及评价能力,明确化学反应原理是解本题关键,注意CD为易错选项,题目难度中等.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
2.下列有关化学用语使用正确的是( )
| A. | 硫原子的原子结构示意图: | |
| B. | 氯化铵的电子式: [H [H H]+Cl- H]+Cl- | |
| C. | 原子核内有10个中子的氧原子:188O | |
| D. | 用电子式表示水的形成过程:H×+ +×H→ +×H→ |
3.化学在生产、生活中有着广泛的应用,下列叙述不合理的是( )
| A. | 晶体硅熔点高,可制玻璃仪器 | B. | NaHCO3受热分解,可焙制糕点 | ||
| C. | N2化学性质稳定,可作保护气 | D. | 明矾易水解生成胶体,可作净水剂 |
20.某实验小组设计如下实验装置探究电化学原理,装置Ⅰ中Zn电极产生ZnO,下列说法正确的是( )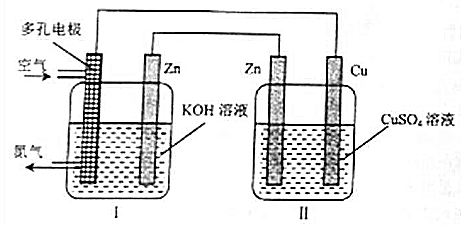

| A. | Cu电极质量增加 | |
| B. | 装置Ⅱ将化学能转变为电能 | |
| C. | 装置Ⅰ中OH-向多孔电极移动 | |
| D. | 多孔电极的电极反应式为:O2+4e-+2H2O═4OH- |
17.设NA为阿伏加徳罗常数的值.下列有关叙述正确的是( )
| A. | 1 mo1H2O分子所含中子数为8NA | |
| B. | 30g乙烷中所含的共价键数为6 NA | |
| C. | 常温下,1LpH=1的H2SO4溶液中,含有H+的数目为0.2 NA | |
| D. | 100 mL0.1mol•L-1的CuCl2溶液中,含有Cu2+的数目为0.01 NA |
6.多巴胺的一种合成路线如图所示:

下列说法正确的是( )

下列说法正确的是( )
| A. | 原料甲与苯酚互为同系物 | |
| B. | 中间产物乙、丙和多巴胺都具有两性 | |
| C. | 多巴胺不可能存在氨基酸类的同分异构体 | |
| D. | 1 mol甲最多可以和2 mol Br2发生取代反应 |


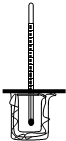 如图所示,大烧杯中放入一小烧杯,两烧杯间空隙用碎纸屑填充,小烧杯上方悬挂一温度计,两烧杯口共盖一泡沫塑料,构成一套简易测量温度变化装置.
如图所示,大烧杯中放入一小烧杯,两烧杯间空隙用碎纸屑填充,小烧杯上方悬挂一温度计,两烧杯口共盖一泡沫塑料,构成一套简易测量温度变化装置.