题目内容
18.下表为周期表中短周期的一部分,若R原子核外有3个未成对电子,说法正确的是( )| R | ||
| X | Y | Z |
| A. | 原子半径大小顺序是:Y>X>R | |
| B. | 其气态氢化物的稳定性顺序是:Z>Y>X>R | |
| C. | X、Y、Z中Z的氧化物对应的水化物的酸性最强 | |
| D. | R的气态氢化物与它的含氧酸之间能发生化学反应 |
分析 若R原子核外有3个未成对电子,由短周期元素相对位置可知,R处于第二周期,X、Y、Z处于第三周期,则R原子核外电子排布为1s22s22p3,故R为N元素,可推知X为P元素、Y为S元素、Z为Cl,结合元素周期律与元素化合物性质解答.
解答 解:若R原子核外有3个未成对电子,由短周期元素相对位置可知,R处于第二周期,X、Y、Z处于第三周期,则R原子核外电子排布为1s22s22p3,故R为N元素,可推知X为P元素、Y为S元素、Z为Cl.
A.同周期自左而右原子半径减小,一般电子层越多原子半径越大,故原子半径X>Y>R,故A错误;
B.同主族自上而下非金属性减弱,氢化物稳定性减弱,氢化物稳定性R>X,故B错误;
C.应描述为X、Y、Z的最高价氧化物对应的水化物中Z的酸性最强,不是最高价含氧酸则不一定,如硫酸为强酸,而次氯酸为弱酸,故C错误;
D.氨气能与硝酸反应生成硝酸铵,故D正确,
故选:D.
点评 本题考查结构性质位置关系应用,侧重对元素周期律的考查,C选项为易错点,学生容易忽略“最高价”.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.分子式为C7H8O的芳香族化合物不可能是( )
| A. | 醇 | B. | 酚 | C. | 醚 | D. | 醛 |
13.氮氧化铝(AlON)是一种空间网状结构,硬度大熔点高的透明材料,描述正确的是( )
| A. | 含有离子键 | B. | 属于原子晶体 | ||
| C. | 既有离子键又有共价键 | D. | 属于离子晶体 |
3.已知N2(g)+3H2(g)?2NH3(g)+Q1反应历程的能量变化如曲线I,说法正确的是( )
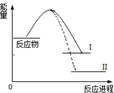

| A. | 1molN≡N键能与3molH-H键能之和大于6molN-H键能,所以反应为放热 | |
| B. | N2(g)+3H2(g)?2NH3(l)+Q2反应历程的能量变化如曲线Ⅱ,则Q2>Q1 | |
| C. | 选择合适的催化剂,可以降低反应所需温度,Q1值也相应减少 | |
| D. | 2mol氨气的能量高于1mol氮气和3mol氢气的能量之和,所以反应需要高温 |
10. 氯的氧化物是氯与氧的二元化合物的总称,也称为氧化氯.目前Cl2O、ClO2、Cl2O7已能制取.有关数据见下表:
氯的氧化物是氯与氧的二元化合物的总称,也称为氧化氯.目前Cl2O、ClO2、Cl2O7已能制取.有关数据见下表:
完成下列填空:
(1)Cl2O是HClO 酸的酸酐,Cl2O电子式为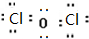 .
.
(2)下列能判断Cl和O两种元素非金属性强弱的是ac(选填编号).
a.氧化氯的分子式 b.与金属反应得电子的数目
c.气态氢化物的稳定性 d.最高价氧化物对应水化物的酸性
(3)根据分子间作用力对沸点影响的变化规律:组成和结构相似的分子,其沸点随着相对分子质量的增大而升高,但上表中相对分子质量是Cl2O7>Cl2O>ClO2,其沸点的变化不是Cl2O7>Cl2O>ClO2的原因是Cl2O7、Cl2O、ClO2结构不相似,不符合分子间作用力对沸点影响的变化规律.
(4)ClO2和碱溶液反应生成亚氯酸盐(阴离子是ClO2-)和氯酸盐,其离子方程式是2ClO2+2OH-=ClO2-+ClO3-+H2O,氧化产物ClO3-.(填离子符号)
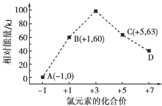
(5)一定条件下,在水溶液中1mol Cl-、ClO${\;}_{x}^{-}$(x=1,2,3,4)的能量(kJ)相对大小如图所示.D是ClO4-(填离子符号).B→A+C的热化学方程式为3ClO-(aq)=ClO3-(aq)+2Cl-(aq)△H=-117kJ/mol(用离子符号表示).
 氯的氧化物是氯与氧的二元化合物的总称,也称为氧化氯.目前Cl2O、ClO2、Cl2O7已能制取.有关数据见下表:
氯的氧化物是氯与氧的二元化合物的总称,也称为氧化氯.目前Cl2O、ClO2、Cl2O7已能制取.有关数据见下表:| 化学式 | Cl2O | ClO2 | Cl2O7 |
| 相对分子质量 | 87 | 67.5 | 183 |
| 沸点/℃ | 2 | 9.7 | 81 |
(1)Cl2O是HClO 酸的酸酐,Cl2O电子式为
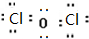 .
.(2)下列能判断Cl和O两种元素非金属性强弱的是ac(选填编号).
a.氧化氯的分子式 b.与金属反应得电子的数目
c.气态氢化物的稳定性 d.最高价氧化物对应水化物的酸性
(3)根据分子间作用力对沸点影响的变化规律:组成和结构相似的分子,其沸点随着相对分子质量的增大而升高,但上表中相对分子质量是Cl2O7>Cl2O>ClO2,其沸点的变化不是Cl2O7>Cl2O>ClO2的原因是Cl2O7、Cl2O、ClO2结构不相似,不符合分子间作用力对沸点影响的变化规律.
(4)ClO2和碱溶液反应生成亚氯酸盐(阴离子是ClO2-)和氯酸盐,其离子方程式是2ClO2+2OH-=ClO2-+ClO3-+H2O,氧化产物ClO3-.(填离子符号)
(5)一定条件下,在水溶液中1mol Cl-、ClO${\;}_{x}^{-}$(x=1,2,3,4)的能量(kJ)相对大小如图所示.D是ClO4-(填离子符号).B→A+C的热化学方程式为3ClO-(aq)=ClO3-(aq)+2Cl-(aq)△H=-117kJ/mol(用离子符号表示).
7.把少量过氧化钠投入下列溶液中,有白色沉淀生成的是( )
| A. | 1mol/L氢氧化钠 | B. | 饱和碳酸氢钠 | C. | 1mol/L硫酸亚铁 | D. | 饱和碳酸钠 |
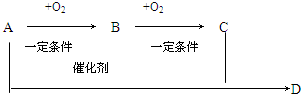 根据如图有机物的转化关系回答.已知A是乙醇.
根据如图有机物的转化关系回答.已知A是乙醇.
 若乙二醇过量,则生成的聚酯纤维可表示为
若乙二醇过量,则生成的聚酯纤维可表示为 .
. .
. 合成PC的2种单体的中:醇(或酚)的结构简式为
合成PC的2种单体的中:醇(或酚)的结构简式为 ,酯的名称为碳酸二苯酚酯.
,酯的名称为碳酸二苯酚酯.