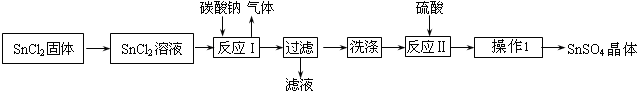
题目内容
已知①25℃、101kPa时,2C(s)+O2(g)=2CO(g);△H=-221kJ/mol ②25℃、101kPa下,碳的燃烧热是393.5kJ/mol.今有120g碳不完全燃烧,所得混合气体对氧气的相对密度为1.则该反应放出的热量是( )
| A、1105 kJ |
| B、1812.5 kJ |
| C、2520 kJ |
| D、3935 kJ |
考点:有关反应热的计算
专题:
分析:混合气体对氧气的相对密度为1,则混合气体CO和二氧化碳的平均相对分子质量为32,则设一氧化碳物质的量为x,二氧化碳为y,则有
=32,解得x:y=3:1,根据C守恒120g碳即10mol的C其中有
变成CO另外
变成CO2,再根据反应热化学方程式进行计算.
| 28x+44y |
| x+y |
| 3 |
| 4 |
| 1 |
| 4 |
解答:
解:因为混合气体对氧气的相对密度为1,则混合气体CO和二氧化碳的平均相对分子质量为32,则设一氧化碳物质的量为x,二氧化碳为y,则有
=32,解得x:y=3:1,根据C守恒120g碳即10mol的C其中有
变成CO另外
变成CO2,再根据反应热化学方程式2C(s)+O2(g)=2CO(g);△H=-221kJ/mol ②25℃、101kPa下,碳的燃烧热是393.5kJ/mol,则放出的热量为:10×
×
+10×
×393.5=1812.5KJ,
故选:B.
| 28x+44y |
| x+y |
| 3 |
| 4 |
| 1 |
| 4 |
| 3 |
| 4 |
| 221 |
| 2 |
| 1 |
| 4 |
故选:B.
点评:本题主要考查了混合气体燃烧放出热量的计算,难度一般,注意平均相对分子质量的十字相乘法的应用;

练习册系列答案
相关题目
某合金是由锌铁按照一定比例熔合而成,其中锌的质量分数为72%.某同学取0.1g该合金粉末进行实验,则所取样品所含铁原子数约为( )
| A、3.01×1020个 |
| B、6.02×1021个 |
| C、7.74×1020个 |
| D、6.67×1020个 |
在我国城市环境中的大气污染物主要是( )
| A、O2、Cl2、HCl、酸雨 |
| B、HCl、SO2、N2、粉尘 |
| C、NH3、CO、CO2、雾 |
| D、SO2、NO2、CO、烟尘 |
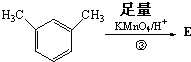 ,则E的分子式为
,则E的分子式为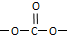 结构在上述同分异构体中,有一类有机物分子中苯环上只有2个取代基,写出其中任一种与足量NaOH溶液共热反应的化学方程式
结构在上述同分异构体中,有一类有机物分子中苯环上只有2个取代基,写出其中任一种与足量NaOH溶液共热反应的化学方程式
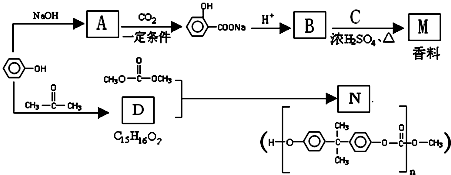
 ,其中取代基-Y中不含支链,含有碳碳双键,咖啡酸有如下转化关系:
,其中取代基-Y中不含支链,含有碳碳双键,咖啡酸有如下转化关系:
 ,试写出D的属于芳香醇的其中2种同分异构体是
,试写出D的属于芳香醇的其中2种同分异构体是