题目内容
某温度下,在一个2L的密闭容器中加入4mol A和2mol B进行如下反应:3A(g)+2B(g)?4C(s)+D(g),反应2min后达到平衡,测得生成1.6mol C,下列说法正确的是( )
| A、前2 min D的平均反应速率为0.2 mol?L-1?min-1 |
| B、此时,B的平衡转化率是40% |
| C、增大该体系的压强,平衡不移动 |
| D、增加B,平衡向右移动,B的平衡转化率增大 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:A.根据消耗的物质的量之比等于化学计量数之比计算生成的D的物质的量,根据v=
计算v(D);
B.根据方程式计算参加反应的B的物质的量,再根据转化率定义计算;
C.该反应是气体的体积减小的反应,增大压强平衡向气体体积减小的反应;
D.增大某一反应物的浓度,平衡向正反应移动,其它反应物的转化率增大,自身转化率降低.
| ||
| △t |
B.根据方程式计算参加反应的B的物质的量,再根据转化率定义计算;
C.该反应是气体的体积减小的反应,增大压强平衡向气体体积减小的反应;
D.增大某一反应物的浓度,平衡向正反应移动,其它反应物的转化率增大,自身转化率降低.
解答:
解:A.反应2min后达到平衡,测得生成1.6molC,根据消耗的物质的量之比等于化学计量数之比,则生成0.4molD,v(D)=
=0.1mol?L-1?min-1,故A错误;
B.根据方程式可知,参加反应的B的物质的量=1.6mol×
=0.8mol,故B的转化率=
×100%=40%,故B正确;
C.该反应是气体的体积减小的反应,增大压强平衡向气体体积减小的反应,故C错误;
D.增加B的用量,B的浓度增大,平衡向正反应方向移动,A的转化率增大,但B的转化率降低,故D错误;
故选B.
| ||
| 2min |
B.根据方程式可知,参加反应的B的物质的量=1.6mol×
| 1 |
| 2 |
| 0.8mol |
| 2mol |
C.该反应是气体的体积减小的反应,增大压强平衡向气体体积减小的反应,故C错误;
D.增加B的用量,B的浓度增大,平衡向正反应方向移动,A的转化率增大,但B的转化率降低,故D错误;
故选B.
点评:本题考查化学平衡常数、化学反应速率与化学平衡计算、影响化学平衡的因素等,难度不大,注意掌握外界条件对化学平衡的影响.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
有两种金属组成的混合物粉末15g与足量的稀盐酸反应,生成11.2L(标况)H2,则该混合物的组成可能是( )
| A、Fe、Zn |
| B、Al、Cu |
| C、Al、Mg |
| D、Al、Fe |
 25℃时,向浓度均为0.1mol.L-1的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液,表示生成Al(OH)3的物质的量与加入的NaOH溶液的体积的关系如图所示(已知当离子浓度小于1×10-5mol.L-1时为沉淀完全).则下列说法与判断合理的是( )
25℃时,向浓度均为0.1mol.L-1的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液,表示生成Al(OH)3的物质的量与加入的NaOH溶液的体积的关系如图所示(已知当离子浓度小于1×10-5mol.L-1时为沉淀完全).则下列说法与判断合理的是( )| A、25℃时,Fe(OH)3的溶解度大于Al(OH)3的溶解度 |
| B、25℃时,Fe(OH)3的溶度积大于Al(OH)3的溶度积 |
| C、当生成的Al(OH)3恰好完全溶解时,溶液中的溶质只有NaAlO2 |
| D、图中2a=b=6(c-b) |
一定温度下存在反应:2SO2(g)+O2(g)?2SO3(g),其正反应放热.现有两个体积相同的密闭容器Ⅰ、Ⅱ,中间隔板不漏气且可自由滑动,按如图所示投料.达到平衡时,下列说法正确的是( )

| A、容器Ⅰ、Ⅱ的右室中SO3的体积分数相同 |
| B、容器Ⅰ、Ⅱ的右室中反应速率I<II |
| C、平衡时容器Ⅰ、Ⅱ中的隔板均应在中间 |
| D、容器II若为绝热容器(隔板不导热),则容器II右室中SO2的转化率与左室SO3的转化率之和小于1 |
在常温常压下,向100mL CH4和Ar的混合气体中通入400mL O2,点燃使其完全反应,最后在相同条件下得到干燥气体450mL,则反应前混合气体中CH4和Ar的物质的量之比为( )
| A、1:4 | B、1:3 |
| C、1:2 | D、1:1 |
测定某含有Na2CO3杂质的NaHCO3样品的纯度,现将20g样品加热,再将产生的CO2和水蒸气通入足量的Na2O2中,发现Na2O2固体增重3g,该样品的纯度(质量分数)是( )
| A、50% | B、84% |
| C、42% | D、16% |
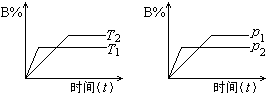 已知某可逆反应:mA(g)+nB(g)?pC(g)+Q(Q为热量变化).在密闭容器中进行,如图所示,反应在不同时间t,温度T和压强p与反应物B在混合气体中的百分含量(B%)的关系曲线,由曲线分析下列判断正确的是( )
已知某可逆反应:mA(g)+nB(g)?pC(g)+Q(Q为热量变化).在密闭容器中进行,如图所示,反应在不同时间t,温度T和压强p与反应物B在混合气体中的百分含量(B%)的关系曲线,由曲线分析下列判断正确的是( )| A、T1<T2,p1>p2,m+n>p,Q<0 |
| B、T1>T2,p2>p1,m+n>p,Q<0 |
| C、T1>T2,p2>p1,m+n<p,Q<0 |
| D、T1>T2,p1<p2,m+n>p,Q>0 |
 电浮选凝聚法是工业上采用的一种污水处理方法如图是电解污水装置示意图.
电浮选凝聚法是工业上采用的一种污水处理方法如图是电解污水装置示意图. 次氯酸钠(NaClO)和藏氯酸钠(NaClO)都是重要的含氯消毒剂.
次氯酸钠(NaClO)和藏氯酸钠(NaClO)都是重要的含氯消毒剂.