题目内容
归纳整理是科学学习的重要方法之一.在学习了VIA族元素的各种性质后,可归纳出如下所示的表格(部分):
请根据上表回答下列问题:
(1)硒的熔点范围可能是
(2)碲的化合价可能有
(3)硫、硒、碲的氢化物水溶液的酸性由强到弱的顺序是 (填化学式)
(4)氢硒酸有较强的 (填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生的化学方程式为 
(5)已知:在热力学标准态(298K,1.01×105Pa)下,由稳定的单质发生反应生成1mol化合物的反应热叫该反应的生成热(△H).如图为氧族元素的四种氢化物(用a、b、c、d表示)的生成热数据示意图,
试回答下列问题:水的生成热△H为
请你归纳:非金属元素氢化物的稳定性与氢化物的生成热△H的关系 .
写出硒化氢在热力学标准态下发生分解反应的热化学方程式: .
| 元素 性质 | 氧(8O) | 硫(16S) | 硒(34Se) | 碲(52Te) | |
| 单质熔点(℃) | -218.4 | 113 | 450 | ||
| 单质沸点(℃) | -183 | 444.6 | 685 | 1390 | |
| 主要化合价 | -2 | -2、+4、+6 | -2、+4、+6 | ||
| 原子半径 | 逐渐增大 | ||||
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 能直接化合 | |
(1)硒的熔点范围可能是
(2)碲的化合价可能有
(3)硫、硒、碲的氢化物水溶液的酸性由强到弱的顺序是
(4)氢硒酸有较强的

(5)已知:在热力学标准态(298K,1.01×105Pa)下,由稳定的单质发生反应生成1mol化合物的反应热叫该反应的生成热(△H).如图为氧族元素的四种氢化物(用a、b、c、d表示)的生成热数据示意图,
试回答下列问题:水的生成热△H为
请你归纳:非金属元素氢化物的稳定性与氢化物的生成热△H的关系
写出硒化氢在热力学标准态下发生分解反应的热化学方程式:
考点:同一主族内元素性质递变规律与原子结构的关系,热化学方程式
专题:化学反应中的能量变化,元素周期律与元素周期表专题
分析:(1)同一主族单质的熔沸点随着原子序数增大而增大;
(2)同一主族元素性质具有相似性;
(3)元素的非金属性越强,其气态氢化物的水溶液酸性越弱;
(4)氢硒酸易失电子而具有还原性,易被空气氧化;
(5)同一主族元素,随着原子序数增大,其非金属性逐渐减弱,则其气态氢化物的稳定性随着原子序数增大而减弱;根据热力学知识知,能量越低的物质其稳定性越强;根据图象判断a、b、c、d分别对应的氢化物,结合焓变大小书写方程式.
(2)同一主族元素性质具有相似性;
(3)元素的非金属性越强,其气态氢化物的水溶液酸性越弱;
(4)氢硒酸易失电子而具有还原性,易被空气氧化;
(5)同一主族元素,随着原子序数增大,其非金属性逐渐减弱,则其气态氢化物的稳定性随着原子序数增大而减弱;根据热力学知识知,能量越低的物质其稳定性越强;根据图象判断a、b、c、d分别对应的氢化物,结合焓变大小书写方程式.
解答:
解:(1)氧族元素单质都是分子晶体,氧族元素单质的熔沸点随着原子序数增大而增大,所以硒的熔点范围可能是113~450℃,故答案为:113~450℃;
(2)根据表中数据知,从S开始出现-2、+4、+6价,所以碲的化合价可能有:-2、+4、+6,故答案为:-2、+4、+6;
(3)氧族元素非金属性随着原子序数增大而减弱,则其阴离子结合氢离子能力越弱,所以元素的非金属性越强,其气态氢化物的水溶液酸性越弱,非金属性S>Se>Te,所以硫、硒、碲的氢化物水溶液的酸性由强到弱的顺序是H2Te>H2Se>H2S,故答案为:H2Te>H2Se>H2S;
(4)氢硒酸易失电子而具有还原性,易被空气氧化生成Se单质,反应方程式为2H2Se+O2═2H2O+2Se,故答案为:还原性;2H2Se+O2═2H2O+2Se;
(5)非金属元素氢化物的稳定性与生成1mol氢化物时的△H的关系为:根据元素周期律,同一主族元素非金属性越强,生成气态氢化物越容易,气态氢化物越稳定;而根据热力学,能量越低越稳定.a、b、c、d依次为H2Te、H2Se、H2S、H2O,所以水的生成热△H为-242 kJ?mol-1,
b点为H2Se,根据焓变知,硒化氢在热力学标准态下发生分解反应的热化学方程式H2Se(g)=Se(s)+H2(g);△H=-82kJ?mol-1,故答案为:-242 kJ?mol-1;非金属元素氢化物越稳定,△H越小,反之亦然;H2Se(g)=Se(s)+H2(g)△H=-81kJ?mol-1 .
(2)根据表中数据知,从S开始出现-2、+4、+6价,所以碲的化合价可能有:-2、+4、+6,故答案为:-2、+4、+6;
(3)氧族元素非金属性随着原子序数增大而减弱,则其阴离子结合氢离子能力越弱,所以元素的非金属性越强,其气态氢化物的水溶液酸性越弱,非金属性S>Se>Te,所以硫、硒、碲的氢化物水溶液的酸性由强到弱的顺序是H2Te>H2Se>H2S,故答案为:H2Te>H2Se>H2S;
(4)氢硒酸易失电子而具有还原性,易被空气氧化生成Se单质,反应方程式为2H2Se+O2═2H2O+2Se,故答案为:还原性;2H2Se+O2═2H2O+2Se;
(5)非金属元素氢化物的稳定性与生成1mol氢化物时的△H的关系为:根据元素周期律,同一主族元素非金属性越强,生成气态氢化物越容易,气态氢化物越稳定;而根据热力学,能量越低越稳定.a、b、c、d依次为H2Te、H2Se、H2S、H2O,所以水的生成热△H为-242 kJ?mol-1,
b点为H2Se,根据焓变知,硒化氢在热力学标准态下发生分解反应的热化学方程式H2Se(g)=Se(s)+H2(g);△H=-82kJ?mol-1,故答案为:-242 kJ?mol-1;非金属元素氢化物越稳定,△H越小,反之亦然;H2Se(g)=Se(s)+H2(g)△H=-81kJ?mol-1 .
点评:本题考查同一主族性质的递变性及相似性,同时考查学生分析问题、解决问题能力,明确同一主族性质递变规律是解本题关键,注意同一主族元素气态氢化物的水溶液酸性强弱、最高价氧化物的水化物酸性强弱的区别,为易错点.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
下列是能与金属钠反应的系列物质,在排列H2O、C6H5OH、□CH3COOH、HCl中,□内应填入的物质是( )
| A、H2SO4 |
| B、CH3CH2OH |
| C、H2CO3 |
| D、CH3COOCH3 |
已知:将一定量Cl2通入KOH溶液,可能生成KCl、KClO、KClO3,且
的值与温度高低有关.当n(KOH)=6a mol时,下列有关说法错误的是( )
| c(Cl-) |
| c(ClO-) |
A、若某温度下,反应后
| ||||||
| B、参加反应的氯气的物质的量等于3a mol | ||||||
| C、改变温度,反应中转移电子的物质的量ne的范围:3a mol<ne<5a mol | ||||||
| D、改变温度,产物中KClO3的最大理论产量为a mol |
用如图实验装置和方法进行相应实验,能达到实验目的是( )
A、 分离乙醇与乙酸 |
B、 向容量瓶中转移液体 |
C、 制备少量氨气 |
D、 分馏石油 |

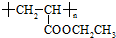 可用于制备涂料,其单体结构简式为
可用于制备涂料,其单体结构简式为 )广泛存在于水果中,尤以苹果、葡萄、西瓜、山楂内为多.
)广泛存在于水果中,尤以苹果、葡萄、西瓜、山楂内为多.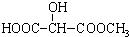 B.
B. C.H3COOC-COOCH3
C.H3COOC-COOCH3 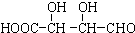 E.
E.