题目内容
8.工业上电解氧化铝以冰晶石(Na3AlF6)作助熔剂,已知冰晶石难溶于水.用萤石(CaF2)为原料生产Na3AlF6的流程如下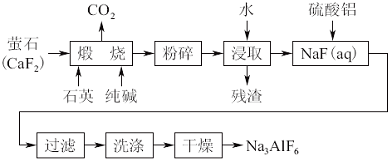
试结合生产流程回答下列问题:
(1)上述流程中涉及的过滤操作所用的玻璃仪器有烧杯、玻璃棒和漏斗;
(2)用水浸取后所得残渣的主要成分是CaSiO3,请写出煅烧时总反应的化学方程式CaF2+SiO2+Na2CO3$\frac{\underline{\;高温\;}}{\;}$CaSiO3+2NaF+CO2↑;
(3)煅烧产生的气体可用于联合制碱,其相应的化学方程式为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;煅烧后的固体在浸取前进行粉碎的目的是使NaF快速完全溶解;
(4)干燥前,检验冰晶石是否洗涤干净的实验方法是取最后一次洗涤液少量于试管中,滴加氯化钡溶液,若不产生白色沉淀证明已洗涤干净,反之,则未洗涤干净;
(5)向NaF溶液中加入硫酸铝溶液发生反应的离子方程式:6F-+Al3++3Na+═Na3AlF6↓;NaF溶液呈碱性,因此在加入硫酸铝溶液前,需先用硫酸将NaF溶液的pH下调至5左右,否则可能产生副产物Al(OH)3;
(6)975kg含CaF2 80%的萤石(杂质不含氟元素)理论上可生产Na3AlF6700kg(设生产过程中的每一步含氟物质均完全转化).
分析 工业上生产Na3AlF6的主要流程:氟化钙、石英、纯碱高温煅烧:CaF2+Na2CO3 +SiO2$\frac{\underline{\;高温\;}}{\;}$CO2↑+2NaF+CaSiO3↓,加水浸取,残渣为CaSiO3,加入硫酸铝,硫酸铝与NaF(aq)反应的离子方程式为:3Na++6F-+Al3+=Na3AlF6↓,过滤、洗涤、干燥得纯净的Na3AlF6产品,
(1)过滤操作所用的玻璃仪器有烧杯、漏斗、玻璃棒;
(2)煅烧时的反应物有CaF2、SiO2、Na2CO3,生成物已知的有CO2、CaSiO3,根据质量守恒定律可知另一产物为NaF,得到煅烧时方程式;
(3)联合制碱法又称侯氏制碱法,其基础反应为NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;工业上粉碎固体的目的一般为增大接触面积,加快反应速率,或溶解速率;
(4)冰晶石如果没有洗净,则最后一次洗涤液中会有Na+或SO42-,一般检验SO42-;
(5)向NaF溶液中加入硫酸铝溶液,生成物为不溶于水的Na3AlF6,直接得到离子方程式;向NaF溶液中加入硫酸铝溶液可以得到Na3AlF6,氟调子水解,溶液呈碱性,溶液pH较高时,铝离子会生成氢氧化铝沉淀;
(6)根据氟元素守恒可计算出Na3AlF6的质量.
解答 解:工业上生产Na3AlF6的主要流程:氟化钙、石英、纯碱高温煅烧:CaF2+Na2CO3 +SiO2$\frac{\underline{\;高温\;}}{\;}$CO2↑+2NaF+CaSiO3↓,加水浸取,残渣为CaSiO3,加入硫酸铝,硫酸铝与NaF(aq)反应的离子方程式为:3Na++6F-+Al3+=Na3AlF6↓,过滤、洗涤、干燥得纯净的Na3AlF6产品,
(1)过滤操作所用的玻璃仪器有烧杯、漏斗、玻璃棒,故答案为:烧杯;玻璃棒;
(2)煅烧时的反应物有CaF2、SiO2、Na2CO3,生成物已知的有CO2、CaSiO3,根据质量守恒定律可知另一产物为NaF,得到煅烧时方程式;CaF2+SiO2+Na2CO3═CaSiO3+2NaF+CO2↑,故答案为:CaF2+SiO2+Na2CO3═CaSiO3+2NaF+CO2↑;
(3)联合制碱法又称侯氏制碱法,其基础反应为NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;工业上粉碎固体的目的一般为增大接触面积,加快反应速率,或溶解速率,故答案为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;使NaF快速完全溶解;
(4)冰晶石如果没有洗净,则最后一次洗涤液中会有Na+或SO42-,一般检验SO42-,故答案为:取最后一次洗涤液少量于试管中,滴加氯化钡溶液,若不产生白色沉淀证明已洗涤干净,反之,则未洗涤干净(也可用焰色反应检验Na+);
(5)向NaF溶液中加入硫酸铝溶液,生成物为不溶于水的Na3AlF6,直接得到离子方程式为6F-+Al3++3Na+═Na3AlF6↓;向NaF溶液中加入硫酸铝溶液可以得到Na3AlF6,氟调子水解,溶液呈碱性,溶液pH较高时,铝离子会生成氢氧化铝沉淀,故答案为:6F-+Al3++3Na+═Na3AlF6↓;Al(OH)3;(6)975kg萤石中氟元素的物质的量为 $\frac{975×1000×80%}{78}$×2mol=2000mol,根据氟元素守恒可知,理论上可生产Na3AlF6的质量为210×2000×$\frac{1}{6}$g=700kg,故答案为:700.
点评 本题考查了Na3AlF6的制备,涉及物质的分离与提纯、离子反应方程式的书写、化学计算,理解原理以及熟练综合应用元素化合物知识是解答关键,题目难度中等.

 应用题作业本系列答案
应用题作业本系列答案| A. | 形成了X3+离子和Y2-离子 | B. | 形成的化合物中含有离子键 | ||
| C. | 形成分子式为X3Y2的化合物 | D. | 形成的化合物可能具有两性 |
| A. | 离子化合物中可能含共价键 | |
| B. | 共价化合物中可能含离子键 | |
| C. | 两种元素构成的共价化合物分子中的化学键都是极性键 | |
| D. | 含有非极性键的化合物一定是共价化合物 |
| A. | 核内的中子数为53 | |
| B. | 核内的电子数为135 | |
| C. | 核内的中子数与核外电子数之差为29 | |
| D. | 质量数为82 |
| A. | 卤化氢分子中,卤素的非金属性越强,共价键的极性也越强,稳定性也越强 | |
| B. | 以极性键结合的分子,不一定是极性分子 | |
| C. | 判断A2B或AB2型分子为极性分子必须知道该分子的空间构型 | |
| D. | 非极性分子中,各原子间都应以非极性键结合 |
| A. | X的最高价氧化物对应水化物的酸性大于W | |
| B. | Z的气态氢化物的稳定性大于W | |
| C. | YZ和ZW2所含化学键类型相同 | |
| D. | 简单离子半径:r(Y2+)<r(X-)<r(W-)<r(Z2-) |
