题目内容
6.分枝酸可用于生化研究,其结构简式如图.下列关于分枝酸的叙述正确的是( )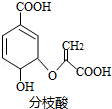
| A. | 可与乙醇、乙酸反应,且反应类型相同 | |
| B. | 分子中含有3种官能团 | |
| C. | 1mol分枝酸最多可与3molNaOH发生中和反应 | |
| D. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同 |
分析 由结构可知,分子中含-COOH、碳碳双键、-OH、醚键,结合羧酸、烯烃、醇的性质来解答.
解答 解:A.可与乙醇、乙酸反应,均为酯化反应,反应类型相同,故A正确;
B.含-COOH、碳碳双键、-OH、醚键四种官能团,故B错误;
C.只有-COOH与NaOH反应,则1mol分枝酸最多可与2molNaOH发生中和反应,故C错误;
D.含碳碳双键,与溴发生加成反应,与高锰酸钾发生氧化反应,原理不同,故D错误;
故选A.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意有机物的性质及有机反应,题目难度不大.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
16.下表是部分短周期元素的原子半径及主要化合价,根据表中信息判断以下叙述正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nmm | 0.160 | 0.134 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | L2+与R2-的核外电子数相等 | B. | L与T形成的化合物具有两性 | ||
| C. | L和Q金属性:Q<L | D. | 氢化物的稳定性为H2T<H2R |
17.关于化学键的下列叙述中,正确的是( )
| A. | 原子或离子间相互的吸引力叫化学键 | |
| B. | 共价化合物可能含离子键,离子化合物中只含离子键 | |
| C. | 构成单质分子的微粒一定含有共价键 | |
| D. | 共价化合物内部可能有极性键和非极性键 |
14.已知X、Y、Z为三种原子序数相连的元素,最高价氧化物对应水化物的酸性相对强弱是:HXO4>H2YO4>H3ZO4.则下列说法不正确的是( )
| A. | 气态氢化物的稳定性:HX>H2Y>ZH3 | |
| B. | 非金属活泼性:Z<Y<X | |
| C. | 单质的氧化性:X2>Y>Z | |
| D. | X与Z形成的化合物均能达8电子稳定结构 |
11.下列说法正确的是( )
| A. | 做银镜反应后的试管用氨水洗涤 | |
| B. | 苯酚如不慎沾到皮肤上,应立即用酒精洗涤 | |
| C. | 乙酸乙酯与稀硫酸混合水浴加热,酯层完全消失 | |
| D. | 向2mL10%硫酸铜溶液滴加4~6滴2%氢氧化钠溶液中,再加入0.5mL乙醛溶液加热,有红色沉淀出现 |
16.下列有关反应的离子方程式正确的是( )
| A. | 碳酸的电离方程式:H2CO3═2H++CO32- | |
| B. | NaHSO4(溶液)的电离:NaHSO4═Na++H++SO42- | |
| C. | 明矾可用于净水:Al3++3H2O═Al(OH)3↓+3H+ | |
| D. | HCO3-的水解方程式为:HCO3-+H2O═CO32-+H3O+ |
 .
.