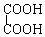题目内容
17.填写下列空白:(数值或单位错位不得分)(1)H2SO4的摩尔质量为98g•mol-1;
(2)要使NH3与CH4含相同数目的H原子,则NH3和CH4的物质的量之比为4:3.
(3)相等质量的CO和CO2,相同条件下的体积之比为11:7.
(4)标准状况下,密度为0.75g•L-1的NH3与CH4组成的混合气体,该混合气体是氢气密度的8.4倍.
(5)已知a g A和b g B恰好完全反应生成0.2mol C和d g D,则C的摩尔质量为5(a+b-d)g•mol-1.
分析 (1)以g/mol为单位,摩尔质量数值上与相对分子质量;
(2)NH3与CH4中氢原子个数之比为3:4;
(3)依据n=$\frac{m}{M}$=$\frac{V}{Vm}$解答;
(4)根据M=ρVm计算平均摩尔质量,相同条件下.气体密度之比等于摩尔质量之比;
(5)依据质量守恒计算C的质量,依据M=$\frac{m}{n}$计算.
解答 解:(1)H2SO4的相对分子质量为98,摩尔质量为 98g•mol-1,
故答案为:98g•mol-1;
(2)NH3与CH4中氢原子个数之比为3:4,故要使NH3与CH4含相同数目的H原子,则NH3和CH4的物质的量之比为4:3,
故答案为:4:3;
(3)依据n=$\frac{m}{M}$=$\frac{V}{Vm}$,可知质量相同的CO和CO2,相同条件下气体的体积之比与摩尔质量成反比,即:44:28=11:7;
故答案为:11:7;
(4)混合气体平均摩尔质量为0.75g•L-1×22.4L/mol=16.8g/mol,气体密度之比等于摩尔质量之比,则该混合气体对氢气的相对密度为$\frac{16.8g/mol}{2g/mol}$=8.4,
故答案为:8.4;
(5)已知a g A和b g B恰好完全反应生成0.2mol C和d g D,依据质量守恒可知C的质量为:a+b-d,则其摩尔质量为::$\frac{a+b-d}{0.2mol}$=5(a+b-d) g•mol-1;
故答案为:5(a+b-d) g•mol-1.
点评 本题考查了物质的量有关计算,明确以物质的量为核心计算公式是解题关键,题目难度不大.

练习册系列答案
 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
7.下面三幅图中,与胶体有关的是( )


| A. | 只有① | B. | ②③ | C. | 只有③ | D. | 全部 |
9.在 500mL KNO3和 Cu(NO3)2 的混合溶液中,c(NO3-)=6mol/L,用石墨电极电解此溶液,当通电一段时间后,两极均收集到 22.4L 气体(标准状况),假定电解后溶液体积仍为 500mL,下列说法正确的是( )
| A. | 电解得到的 Cu 的物质的量为 0.5 mol | |
| B. | 向电解后的溶液中加入 98 g 的 Cu(OH)2 可恢复为原溶液 | |
| C. | 原混合溶液中 c(K+)=4 mol/L | |
| D. | 电解后溶液中 c(H+)=2 mol/L |
6.不慎划破手指出血时,可立即在出血点处滴FeCl3溶液应急止血,其原因是( )
| A. | FeCl3具有强氧化性,使血液中的蛋白质被氧化凝固止血 | |
| B. | FeCl3与血液发生化学反应,生成沉淀物质而止血 | |
| C. | FeCl3水解生成Fe(OH)3沉淀而沉积于划破处止血 | |
| D. | FeCl3是电解质,使血液中的蛋白质很快疑结而止血 |
7.在密闭容器中发生如下反应:mA(g)+nB(g)?pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度为原来2.1倍,下列说法错误的是( )
| A. | 平衡向正反应方向移动 | B. | A的转化率增大 | ||
| C. | m+n<p | D. | C的体积分数增加 |
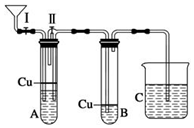 某化学课外兴趣小组为探究NO气体易被空气氧化,并观察NO气体的实际颜色,同时为了防止气体扩散污染空气,对实验室制取NO气体的装置改装如下:
某化学课外兴趣小组为探究NO气体易被空气氧化,并观察NO气体的实际颜色,同时为了防止气体扩散污染空气,对实验室制取NO气体的装置改装如下: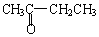
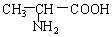 与
与
 与
与
 与
与