题目内容
食盐中含有一定量的镁、铁等物质,加碘盐中碘的损失主要由于杂质、水分、空气中的氧气以及光照、受热而引起的,已知:
氧化性:IO3->Fe3+>I2;还原性:S2O32->I-
3I2+6OH-═5I-+IO3-+3H2O KI+I2═KI3
(1)某学习小组对加碘盐进行了如下实验:取一定量加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分3份.第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显示淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色.①加KSCN溶液显红色,该试液中含有的物质是 (用离子符号表示);CCl4中显示紫红色的物质是 (用电子式表示).
②第二份试液中加入足量KI固体后,反应的离子方程式为 .
(2)将I2溶于KI溶液,在低温条件下,可制得KI3?H2O.该物质作为食盐加碘剂是否合适?(填“是”或“否”),并说明理由: .
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失.下列物质中有可能作为稳定剂的是 .
A.Na2S2O3 B.AlCl3C.Na2CO3 D.NaNO2.
氧化性:IO3->Fe3+>I2;还原性:S2O32->I-
3I2+6OH-═5I-+IO3-+3H2O KI+I2═KI3
(1)某学习小组对加碘盐进行了如下实验:取一定量加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分3份.第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显示淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色.①加KSCN溶液显红色,该试液中含有的物质是
②第二份试液中加入足量KI固体后,反应的离子方程式为
(2)将I2溶于KI溶液,在低温条件下,可制得KI3?H2O.该物质作为食盐加碘剂是否合适?(填“是”或“否”),并说明理由:
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失.下列物质中有可能作为稳定剂的是
A.Na2S2O3 B.AlCl3C.Na2CO3 D.NaNO2.
考点:物质的检验和鉴别的实验方案设计,氯、溴、碘及其化合物的综合应用
专题:实验设计题,卤族元素
分析:(1)①给出的离子中,只有Fe3+遇KSCN溶液显红色,Fe3+与KI发生氧化还原反应生成的碘单质,易溶于有机溶剂,且碘在四氯化碳中显紫色;
②具有氧化性的离子为IO3-与具有还原性的离子为I-,发生氧化还原反应;
(2)根据KI具有还原性及氧化还原反应、KI3在常温下不稳定性来分析;
(3)根据提高加碘盐(添加KI)的稳定性,主要是防止I- 被氧化来分析;
(4)将亚铁离子转化为铁离子,再利用铁离子遇KSCN溶液变红色来检验.
②具有氧化性的离子为IO3-与具有还原性的离子为I-,发生氧化还原反应;
(2)根据KI具有还原性及氧化还原反应、KI3在常温下不稳定性来分析;
(3)根据提高加碘盐(添加KI)的稳定性,主要是防止I- 被氧化来分析;
(4)将亚铁离子转化为铁离子,再利用铁离子遇KSCN溶液变红色来检验.
解答:
解:(1)某加碘盐可能含有KIO3、KI、Mg2+、Fe3+,用蒸馏水溶解,并加稀盐酸酸化后将溶液分为3份.从第一份试液中滴加KSCN溶液后显红色,可知该加碘盐中含有Fe3+,反应:Fe3++3SCN-=Fe(SCN)3,Fe(SCN)3呈血红色;从第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色,可知有碘生成.这是因为由于“氧化性:IO3->Fe3+>I2”,加足量KI后,IO3-和Fe3+均能将I-氧化成I2,由此也可以知道该加碘盐添加KIO3;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色.由此可知该加碘盐中不含KI.
①该加碘盐溶液中加KSCN溶液显红色的物质是Fe(SCN)3,则溶液中含Fe3+,CCl4中显紫红色的物质是I2,电子式 ,故答案为:Fe3+;
,故答案为:Fe3+; ;
;
②第二份试液中加入足量KI固体后,反应的离子方程式为2Fe3++2I-=2Fe2++I2、IO3-+5I-+6H+═3I2+3H2O,
故答案为:2Fe3++2I-=2Fe2++I2、IO3-+5I-+6H+═3I2+3H2O;
(2)KI作为加碘剂的食盐在保存过程中,KI会被空气中氧气氧化,KI在潮湿空气中氧化的反应化学方程式为:4KI+O2+2H2O═2I2+4KOH,根据题目告知,KI3?H2O是在低温条件下,由I2溶于KI溶液可制得.再由题给的信息:“KI+I2 KI3”,可知KI3在常温下不稳定性,低温条件下易分解为KI和I2,KI又易被空气中的氧气氧化,I2易升华,所以KI3?H2O作为食盐加碘剂是不合适的,故答案为:否,低温制备的KI3受热易分解为I2,而I2受热易升华;
KI3”,可知KI3在常温下不稳定性,低温条件下易分解为KI和I2,KI又易被空气中的氧气氧化,I2易升华,所以KI3?H2O作为食盐加碘剂是不合适的,故答案为:否,低温制备的KI3受热易分解为I2,而I2受热易升华;
(3)提高加碘盐(添加KI)的稳定性,主要是防止I- 被氧化,根据题给信息“还原性:S2O32->I-”和氧化还原反应的强弱规律,可以选Na2S2O3作稳定剂;又由题给信息
“3I2+6OH-═IO3-+5I-+3H2O”,可知I2与OH-会发生反应生成IO3-和5I-,而Na2CO3水解呈碱性,因而也可以用Na2CO3作稳定剂,防止加碘盐(添加KI)在潮湿环境下被氧气氧化.至于AlCl3,水解后呈酸性,且还原性I->Cl-,所不能作稳定剂;NaNO2当遇强还原性物质时能表现出氧化性,则NaNO2与KI能发生氧化还原反应为2NO2-+2I-+4H+=2NO↑+I2+2H2O,所以不能作稳定剂,故答案为:AC.
①该加碘盐溶液中加KSCN溶液显红色的物质是Fe(SCN)3,则溶液中含Fe3+,CCl4中显紫红色的物质是I2,电子式
 ,故答案为:Fe3+;
,故答案为:Fe3+; ;
; ②第二份试液中加入足量KI固体后,反应的离子方程式为2Fe3++2I-=2Fe2++I2、IO3-+5I-+6H+═3I2+3H2O,
故答案为:2Fe3++2I-=2Fe2++I2、IO3-+5I-+6H+═3I2+3H2O;
(2)KI作为加碘剂的食盐在保存过程中,KI会被空气中氧气氧化,KI在潮湿空气中氧化的反应化学方程式为:4KI+O2+2H2O═2I2+4KOH,根据题目告知,KI3?H2O是在低温条件下,由I2溶于KI溶液可制得.再由题给的信息:“KI+I2
 KI3”,可知KI3在常温下不稳定性,低温条件下易分解为KI和I2,KI又易被空气中的氧气氧化,I2易升华,所以KI3?H2O作为食盐加碘剂是不合适的,故答案为:否,低温制备的KI3受热易分解为I2,而I2受热易升华;
KI3”,可知KI3在常温下不稳定性,低温条件下易分解为KI和I2,KI又易被空气中的氧气氧化,I2易升华,所以KI3?H2O作为食盐加碘剂是不合适的,故答案为:否,低温制备的KI3受热易分解为I2,而I2受热易升华;(3)提高加碘盐(添加KI)的稳定性,主要是防止I- 被氧化,根据题给信息“还原性:S2O32->I-”和氧化还原反应的强弱规律,可以选Na2S2O3作稳定剂;又由题给信息
“3I2+6OH-═IO3-+5I-+3H2O”,可知I2与OH-会发生反应生成IO3-和5I-,而Na2CO3水解呈碱性,因而也可以用Na2CO3作稳定剂,防止加碘盐(添加KI)在潮湿环境下被氧气氧化.至于AlCl3,水解后呈酸性,且还原性I->Cl-,所不能作稳定剂;NaNO2当遇强还原性物质时能表现出氧化性,则NaNO2与KI能发生氧化还原反应为2NO2-+2I-+4H+=2NO↑+I2+2H2O,所以不能作稳定剂,故答案为:AC.
点评:本题以日常生活中熟悉的食盐和加碘盐中碘的损失原因为素材,要求通过实验,检验加碘盐中所含有的成分物质,探究保存过程中由于空气中氧气的作用容易引起碘损失的反应、探讨KI3?H2O作为食盐加碘剂是否合适、以及提高加碘盐(添加KI)的稳定性可添加的稳定剂,设计实验方案检验选用KI作为加碘剂的加碘盐中的Fe2+等,从而考查物质的检验、氧化还原反应和氧化还原反应方程式、离子反应和离子反应方程式、电子式、以及实验方案的设计等化学基础知识和基本技能.试题突了有效获取知识并与已有知识整合的能力,突出了能够从新信息中准确提取实质性的内容,并与所学的知识进行有效结合,解决实际问题的能力.体现了新课程《考试说明》(化学部分)对学习能力的要求.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
下列各组离子能大量共存的是( )
| A、I-、ClO-、H+、Na+ |
| B、K+、HCO3-、OH-、NH4+ |
| C、Fe3+、Cu2+、SO42-、Cl- |
| D、Ca2+、Na+、SO42-、SO32- |
据最新报道,科学家最近开发出一种生物活性吸附剂,可以吸附水中大部分的微生物和噬菌体.这种新的吸附剂由成本低廉、利于环保的棉纤维素和主要成分为氢氧化铝的勃姆石制造而成.下列有关说法中不正确的是( )
| A、Al(OH)3既能够与盐酸反应又能够与NaOH溶液反应 |
| B、这种吸附剂也能吸附色素 |
| C、向Al2(SO4)3溶液中加入过量的NaOH溶液也能得到Al(OH)3 |
| D、实验室中Al(OH)3可以由可溶性铝盐溶液与足量的氨水反应制得 |
 近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n.已知,最简单的氢铝化合物Al2H6的球棍模型如图所示,它的熔点为150℃,燃烧热极高.下列说法错误的是( )
近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n.已知,最简单的氢铝化合物Al2H6的球棍模型如图所示,它的熔点为150℃,燃烧热极高.下列说法错误的是( )| A、氢铝化合物与水反应生成氢氧化铝和氢气 |
| B、Al2H6中含有离子键和极性共价键 |
| C、氢铝化合物可能成为未来的储氢材料和火箭燃料 |
| D、氢铝化合物中可能存在组成为AlnH2n+2的物质(n为正整数) |
常温下,下列各组离子在所给条件下一定能够大量共存的是( )
| A、pH=0的溶液中:Fe3+、Mg2+、Cl-、SO42- |
| B、水电离出的c(H+)=1×10-10的溶液中:K+、HCO3-、Na+、S2- |
| C、使pH试纸显深蓝色的溶液中:Cu2+、Fe3+、NO3-、SO42- |
| D、能与金属铝反应放出氢气的溶液:Mg2+、SO42-、NO3-、Na+ |
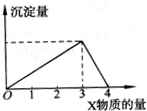 将X气体(或溶液)慢慢通入(或加入)一定量的Y溶液中,产生沉淀量与加入X的物质的量(mol)的关系如图所示,符合如图情况的是( )
将X气体(或溶液)慢慢通入(或加入)一定量的Y溶液中,产生沉淀量与加入X的物质的量(mol)的关系如图所示,符合如图情况的是( )| A、X为NaOH溶液,Y为Al2(SO4)3溶液 |
| B、X为CO2,Y为Ca(OH)2溶液 |
| C、X为NH3,Y为AlCl3溶液 |
| D、X为HCl溶液,Y为Na[Al(OH)4]溶液 |
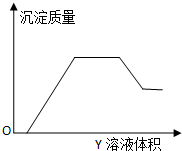 向X溶液中缓慢滴加Y溶液,生成沉淀的质量如图所示,表中符合图象的一组是( )
向X溶液中缓慢滴加Y溶液,生成沉淀的质量如图所示,表中符合图象的一组是( )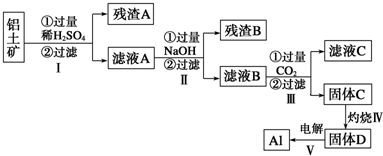
 浓H2SO4和木炭在加热时发生反应的化学方程式是2H2SO4(浓)+C
浓H2SO4和木炭在加热时发生反应的化学方程式是2H2SO4(浓)+C