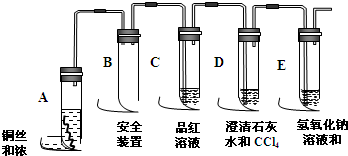
题目内容
铝用途广泛,用铝土矿(主要成分为Al2O3?nH2O、少量SiO2和Fe2O3)制取Al有如下途径:
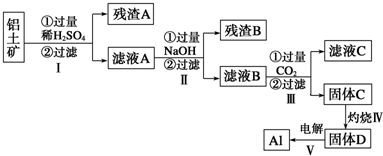
(1)滤液A加过量NaOH离子方程式表示为
(2)灼烧时盛放药品的仪器名称是 .
(3)步骤Ⅳ中发生反应的化学方程式是 .
(4)步骤Ⅲ中生成固体C的离子反应方程式为 .
(5)取滤液B 100mL,加入1mol?L-1盐酸200mL,沉淀量达到最大且质量为11.7g.则滤液B中c(AlO
)= ,c(Na+) 6mol?L-1(填“>”、“=”或“<”).

(1)滤液A加过量NaOH离子方程式表示为
(2)灼烧时盛放药品的仪器名称是
(3)步骤Ⅳ中发生反应的化学方程式是
(4)步骤Ⅲ中生成固体C的离子反应方程式为
(5)取滤液B 100mL,加入1mol?L-1盐酸200mL,沉淀量达到最大且质量为11.7g.则滤液B中c(AlO
- 2 |
考点:镁、铝的重要化合物,制备实验方案的设计
专题:几种重要的金属及其化合物
分析:SiO2和硫酸不反应,Fe2O3和氢氧化钠不反应而氧化铝能反应,向偏铝酸钠中通入过量的二氧化碳可以生成氢氧化铝沉淀.铝土矿中加入硫酸,沉淀A为SiO2,滤液A中含有Al2(SO4)3、Fe(SO4)3,加入过量NaOH,沉淀B为Fe(OH)3,滤液B中含有NaAlO2,通入二氧化碳气体,滤液C中含有碳酸钠或碳酸氢钠,氢氧化铝在加热分解可生成氧化铝,以此解答该题.
解答:
解:(1)根据以上分析,滤液A中含有Al2(SO4)3、Fe(SO4)3,加入过量NaOH故反应的离子方程式为4OH-+Al3+═AlO2-+2H2O、Fe3++4OH-═Fe(OH)3↓;
故答案:4OH-+Al3+═AlO2-+2H2O、Fe3++4OH-═Fe(OH)3↓;
(2)根据加热溶液一般在蒸发皿里进行,而固体一般在坩埚中进行,故答案:坩埚;
(3)根据以上分析,固体C为氢氧化铝,所以步骤Ⅳ中发生反应的化学方程式2Al(OH)3
Al2O3+3H2O;故答案:2Al(OH)3
Al2O3+3H2O;
(4)步骤Ⅲ中生成固体C的反应是向滤液B中通入二氧化碳气体,又根据以上分析,滤液B中含有NaAlO2,故反应的离子方程式:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-;故答案:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-;
(5)根据以上分析滤液B中含有硫酸钠、偏铝酸钠、过量的氢氧化钠,向滤液中加入1mol/L盐酸200mL,沉淀量达到最大且质量为11.7g为Al(OH)3的质量,则根据铝原子守恒,c(AlO
)=
=
=1.5mol?L-1
最后所得的溶液中溶质为硫酸钠、氯化钠,根据钠离子守恒有n(NaOH)=n(NaCl)+2(Na2SO4),根据氯离子与硫酸根守恒有n(NaCl)=n(HCl)=0.2L×1mol/L=0.2mol,n(Na2SO4)=n(H2SO4)>3n(Al2(SO4)3)=3×
mol=0.45mol,故n(NaOH)=n(NaCl)+2(Na2SO4)>0.2mol+2×0.45mol=1.1mol,故c(Na+)>
=11mol/L,
故答案:1.5mol?L-1;>;
故答案:4OH-+Al3+═AlO2-+2H2O、Fe3++4OH-═Fe(OH)3↓;
(2)根据加热溶液一般在蒸发皿里进行,而固体一般在坩埚中进行,故答案:坩埚;
(3)根据以上分析,固体C为氢氧化铝,所以步骤Ⅳ中发生反应的化学方程式2Al(OH)3
| ||
| ||
(4)步骤Ⅲ中生成固体C的反应是向滤液B中通入二氧化碳气体,又根据以上分析,滤液B中含有NaAlO2,故反应的离子方程式:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-;故答案:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-;
(5)根据以上分析滤液B中含有硫酸钠、偏铝酸钠、过量的氢氧化钠,向滤液中加入1mol/L盐酸200mL,沉淀量达到最大且质量为11.7g为Al(OH)3的质量,则根据铝原子守恒,c(AlO
- 2 |
| n(Al(OH) 3) |
| V |
| ||
| 0.1 |
最后所得的溶液中溶质为硫酸钠、氯化钠,根据钠离子守恒有n(NaOH)=n(NaCl)+2(Na2SO4),根据氯离子与硫酸根守恒有n(NaCl)=n(HCl)=0.2L×1mol/L=0.2mol,n(Na2SO4)=n(H2SO4)>3n(Al2(SO4)3)=3×
| 11.7 |
| 78 |
| 1.1mol |
| 0.1L |
故答案:1.5mol?L-1;>;
点评:考查混合物的有关计算及反应方程式的书写,难度中等,清楚反应过程是解题的关键,注意守恒思想的运用,简化计算过程.

练习册系列答案
相关题目
Al2O3
AlCl3
Al(OH)3在以Al2O3为原料制备Al(OH)3时,X适宜用的试剂是( )
| HCl |
| X |
| A、NH3?H2O |
| B、CO2 |
| C、NaOH |
| D、HCl |
下列仪器常用于物质分离的是( )
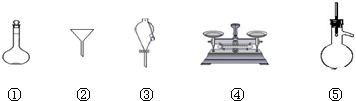

| A、①④⑤ | B、②④⑤ |
| C、②③⑤ | D、①③⑤ |
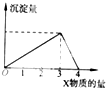 将X气体(或溶液)慢慢通入(或加人)一定量的Y溶液中,产生沉淀量与加入X的物质的量(mol)的关系如图所示,符合如图情况的是( )
将X气体(或溶液)慢慢通入(或加人)一定量的Y溶液中,产生沉淀量与加入X的物质的量(mol)的关系如图所示,符合如图情况的是( )| A、X为NaOH溶液,Y为AlCl3溶液 |
| B、X为CO2,Y为Ca(OH)2溶液 |
| C、X为NH3,Y为AlCl3溶液 |
| D、X为HCl溶液,Y为Na[Al(OH)4]溶液 |
生产、生活离不开各种化学物质,下列说法不正确的是( )
| A、氧化铝可以用来制造耐火坩埚、耐火管和耐高温的实验仪器 |
| B、氢氧燃料电池、铅蓄电池、硅太阳能电池中都利用了原电池原理 |
| C、氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂 |
| D、氨气溶于水显碱性,可以用湿润的红色石蕊试纸检验氨气的生成 |
下列关于Al(OH)3的性质的叙述错误的是( )
| A、Al(OH)3是难溶于水的白色沉淀 |
| B、Al(OH)3能吸附水中的悬浮物 |
| C、Al(OH)3能溶于氨水 |
| D、Al(OH)3属于两性氢氧化物 |