题目内容
Li2MSiO4(M=Mn、Fe、Co等)是极具发展前景的新型锂离子电池电极材料,下面列出了两种制备Li2FeSiO4的方法.
固相法:2Li2SiO3+FeSO4
Li2FeSiO4+Li2SO4+SiO2
溶胶-凝胶法:
(1)固相法中制备Li2FeSiO4的过程必须在惰性气体氛围中进行,其原因是 .
(2)溶胶-凝胶法中,检验溶液中有胶体产生的方法是 ;实验中若制得1mol Li2FeSiO4,整个反应过程中转移电子的数目为 .
(3)以Li2FeSiO4、嵌有Li的石墨为电极,含Li+的导电固体为电解质的锂离子电池,充、放电的总反应式可表示为Li2FeSiO4
Li+LiFeSiO4,该电池放电时的正极反应式为 .
(4)Li2MSiO4的性能对比如下图所示.实际应用时,常用铁元素来源丰富的Li2FeSiO4作电极材料,使用该电极材料的另一个优点是 .

固相法:2Li2SiO3+FeSO4
| ||
| 高温 |
溶胶-凝胶法:

(1)固相法中制备Li2FeSiO4的过程必须在惰性气体氛围中进行,其原因是
(2)溶胶-凝胶法中,检验溶液中有胶体产生的方法是
(3)以Li2FeSiO4、嵌有Li的石墨为电极,含Li+的导电固体为电解质的锂离子电池,充、放电的总反应式可表示为Li2FeSiO4
| 充电 |
| 放电 |
(4)Li2MSiO4的性能对比如下图所示.实际应用时,常用铁元素来源丰富的Li2FeSiO4作电极材料,使用该电极材料的另一个优点是

考点:制备实验方案的设计
专题:实验设计题
分析:(1)依据亚铁离子具有还原性分析;
(2)依据胶体的特征性质分析设计实验验证,依据溶胶-凝胶法中铁元素守恒,铁元素化合价从+3价变化为+2价,若制得1mol Li2FeSiO4,电子转移1mol;
(3)放电时原电池反应,正极上是得到电子发生还原反应,电池反应中元素化合价降低得到电子,依据总反应式分析判断;
(4)依据图象变化意义分析.
(2)依据胶体的特征性质分析设计实验验证,依据溶胶-凝胶法中铁元素守恒,铁元素化合价从+3价变化为+2价,若制得1mol Li2FeSiO4,电子转移1mol;
(3)放电时原电池反应,正极上是得到电子发生还原反应,电池反应中元素化合价降低得到电子,依据总反应式分析判断;
(4)依据图象变化意义分析.
解答:
解:(1)固相法中制备Li2FeSiO4的过程必须在惰性气体氛围中进行,因为亚铁离子具有还原性,易被氧化,所以惰性气体氛围中是为了防止亚铁离子被氧化,
故答案为:防止二价铁被氧化;
(2)胶体具有丁达尔现象,取少量液体,用一束强光光线照射,有丁达尔现象证明是胶体;胶-凝胶法中铁元素守恒,铁元素化合价从+3价变化为+2价,若制得1mol Li2FeSiO4,电子转移1mol,电子转移数为6.02×1023,
故答案为:取少量液体,用一束强光光线照射,有丁达尔现象;6.02×1023;
(3)总反应式可表示为Li2FeSiO4
Li+LiFeSiO4,放电过程中是原电池反应,Li做负极失电子发生氧化反应,LiFeSiO4在正极上得到电子发生还原反应,电极反应为LiFeSiO4+Li++e-=Li2FeSiO4,
故答案为:LiFeSiO4+Li++e-=Li2FeSiO4 ;
(4)实际应用时,常用铁元素来源丰富的Li2FeSiO4作电极材料,分析图象变化可知,使用该电极材料的另一个优点是Li2FeSiO4 充电时脱去Li+所需电压低,
故答案为:Li2FeSiO4 充电时脱去Li+所需电压低.
故答案为:防止二价铁被氧化;
(2)胶体具有丁达尔现象,取少量液体,用一束强光光线照射,有丁达尔现象证明是胶体;胶-凝胶法中铁元素守恒,铁元素化合价从+3价变化为+2价,若制得1mol Li2FeSiO4,电子转移1mol,电子转移数为6.02×1023,
故答案为:取少量液体,用一束强光光线照射,有丁达尔现象;6.02×1023;
(3)总反应式可表示为Li2FeSiO4
| 充电 |
| 放电 |
故答案为:LiFeSiO4+Li++e-=Li2FeSiO4 ;
(4)实际应用时,常用铁元素来源丰富的Li2FeSiO4作电极材料,分析图象变化可知,使用该电极材料的另一个优点是Li2FeSiO4 充电时脱去Li+所需电压低,
故答案为:Li2FeSiO4 充电时脱去Li+所需电压低.
点评:本题考查了物质制备实验分析判断,注意氧化还原反应分析和电子转移计算应用,原电池反应和电极反应书写,图象分析判断是关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
某温度下,已知醋酸的电离常数Ka=1.8×10-5,醋酸银的溶度积Ksp(CH3COOAg)=1.6×10-3,Ksp(Ag2CO3)=8.3×l0-12.在不考虑盐类水解的情况下,下列有关说法正确的是( )
| A、醋酸水溶液中Kw不变,故醋酸对水的电离无影响 |
| B、该温度下饱和醋酸水溶液的pH=5-lgl.8 |
| C、该温度下浓度均为0.01mol?L-1的CH3COONa溶液和AgNO3,溶液等体积混合(混合溶液体积具有加和性),有CH3COOAg沉淀生成 |
| D、将0.02 mol?L-1的Na2CO3,溶液与CH3COOAg沉淀上清液等体积混合,出现白色沉淀 |
25℃时,有下列四种溶液:
①0.1mol/L 的CH3COOH溶液;
②pH=13的NaOH溶液;
③0.05mol/L的 H2SO4溶液;
④0.1mol/L 的Na2CO3溶液.
则下列有关说法中正确的是( )
①0.1mol/L 的CH3COOH溶液;
②pH=13的NaOH溶液;
③0.05mol/L的 H2SO4溶液;
④0.1mol/L 的Na2CO3溶液.
则下列有关说法中正确的是( )
| A、溶液④显碱性,用离子方程式解释其原因可表示成:CO32-+2H2O?H2CO3+2OH- |
| B、在上述四种溶液中,pH由大到小的顺序为:②④①③ |
| C、将该温度下a mL的溶液②与b mL的溶液③混合,所得混合溶液的pH=7,则a:b=1:2 |
| D、若将溶液④和Al2(SO4)3溶液混合,一定可观察到有白色胶状沉淀和无色气体生成 |
用下图所示实验装置进行相应实验,能达到实验目的是( )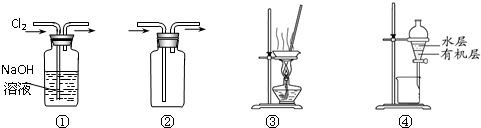

| A、装置①可用于除去Cl2中含有的少量HCl气体 |
| B、按装置②所示的气流方向可用于收集H2、NH3等 |
| C、用图③所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
| D、用图④所示装置分离CCl4萃取碘水后已分层的有机层和水层 |


 ,其分子式为
,其分子式为