题目内容
7.标准状态下,气态分子断开l mol化学键的焓变称为键焓.已知H-H、H-O和O-O键的键焓△H分别为436kJ/mol、463kJ/mol和495kJ/mol.下列热化学方程式正确的是( )| A. | H2O (g)═H2(g)+$\frac{1}{2}$O2(g);△H=-485 kJ/mol | B. | H2O (g)═H2(g)+$\frac{1}{2}$O2(g);△H═+485 kJ/mol | ||
| C. | 2H2(g)+O2 (g)═2H2O(g)△H=+485 kJ/mol | D. | 2H2(g)+O2(g)═2H2O(g)△H=-485 kJ/mol |
分析 旧键断裂需要吸收能量,新键的生成会放出能量,△H=反应物的键能和-生成物的键能和,据此进行解答.
解答 解:A、水分解是吸热反应,应该△H>0,故A错误;
B、△H=2×463kJ/mol-436kJ/mol-$\frac{1}{2}$×495kJ/mol=242.5kJ/mol,故B错误;
C、氢气燃烧放热,应该△H<0,故C错误;
D、△H=2×436kJ/mol+495kJ/mol-4×463kJ/mol=-485kJ/mol,故D正确.
故选:D.
点评 本题考查了热化学方程式的书写、反应热的计算,题目难度中等,注意掌握热化学方程式的书写原则,明确化学键与化学反应中能量变化的关系是解题关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.下列离子方程式书写正确的是( )
| A. | 向次氯酸钙溶液中通入过量的二氧化硫:Ca2++ClO-+SO2+H2O=CaSO4↓+Cl-+2H+ | |
| B. |  溶液中加入过量的碳酸钠: 溶液中加入过量的碳酸钠: | |
| C. | 硝酸铁溶液中加入少量的氢碘酸2NO3-+8H++6I-=3I2+2NO+4H2O | |
| D. | NH4Al(SO4)2溶液中加入少量的氢氧化钠溶液NH4++Al3++4OH-=NH3↑+Al(OH)3↓+H2O |
18.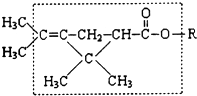 大约在500年前,人们就注意到某些菊科植物的花蕾中存在有杀虫作用的物质.后经研究,凡具有下列方框内结构,且R不是H原子的有机物,就可能是一种高效、低毒、对昆虫有强烈触杀作用的杀虫剂.对此杀虫剂的下列叙述中正确的是( )
大约在500年前,人们就注意到某些菊科植物的花蕾中存在有杀虫作用的物质.后经研究,凡具有下列方框内结构,且R不是H原子的有机物,就可能是一种高效、低毒、对昆虫有强烈触杀作用的杀虫剂.对此杀虫剂的下列叙述中正确的是( )
 大约在500年前,人们就注意到某些菊科植物的花蕾中存在有杀虫作用的物质.后经研究,凡具有下列方框内结构,且R不是H原子的有机物,就可能是一种高效、低毒、对昆虫有强烈触杀作用的杀虫剂.对此杀虫剂的下列叙述中正确的是( )
大约在500年前,人们就注意到某些菊科植物的花蕾中存在有杀虫作用的物质.后经研究,凡具有下列方框内结构,且R不是H原子的有机物,就可能是一种高效、低毒、对昆虫有强烈触杀作用的杀虫剂.对此杀虫剂的下列叙述中正确的是( )| A. | 能发生加氢反应,但其生成物无杀虫作用 | |
| B. | 在酸性溶液中,此类杀虫剂将会失去杀虫作用 | |
| C. | 此类杀虫剂密封保存在碱溶液中,会丧失其杀虫作用 | |
| D. | 左端的甲基(-CH3)不可被替换为H,否则其替代物将失去杀虫作用 |
2.含有离子键的物质是( )
| A. | Cl2 | B. | O3 | C. | NH3 | D. | KOH |
12.下列离子方程式正确的是( )
| A. | 硫化亚铁溶于稀硝酸中:FeS+2H+═Fe2++H2S↑ | |
| B. | 碘水中通入足量的SO2:I2+SO2+2H2O═2I-+SO42-+4H+ | |
| C. | 用惰性电极电解饱和MgCl2溶液:2H2O+2Cl-$\frac{\underline{\;电解\;}}{\;}$H2↑+2OH-+Cl2↑ | |
| D. | NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
19.某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随着加入的NaOH溶液体积变化如图所示,下列说法正确的是
 ( )
( )
 ( )
( )| A. | 原溶液中可能含有Na+、CO32- | |
| B. | 原溶液中一定含有H+、NH4+、Al3+、Mg2+、Fe3+、SO42- | |
| C. | 原溶液中含有的Fe3+和Al3+的物质的量之比为2:1 | |
| D. | CD段溶液中含有的溶质只有Na2SO4、NaAlO2 |
17.在实验室进行物质制备,下列从原料及试剂分别制取相应的最终产物的设计中,理论上正确、操作上可行、经济上合理的是( )
| A. | C$\stackrel{在空气中燃烧}{→}$ CO$\stackrel{CuO△}{→}$ CO2$\stackrel{NaOH溶液}{→}$ Na2CO3 | |
| B. | Cu$\stackrel{AgNO_{3}溶液}{→}$ Cu(NO3)2溶液$\stackrel{NaOH溶液}{→}$ Cu(OH)2 | |
| C. | Fe $\stackrel{点燃}{→}$ Fe2O3$\stackrel{H_{2}SO_{4}溶液}{→}$ Fe2(SO4)3溶液 | |
| D. | CaO$\stackrel{H_{2}O}{→}$ Ca(OH)2溶液$\stackrel{Na_{2}CO_{3}溶液}{→}$ NaOH溶液 |