题目内容
一定量铁粉与硫粉的混合物,加热充分反应后,让反应产物与足量的盐酸反应,在标况下放出2.24升气体,关于加热前后的混合物组成的下列说法正确的是( )
| A、原混合物含0.1molFe |
| B、原混合物的质量可能大于8.8g |
| C、生成物中含0.1molFeS |
| D、加热后的混合物由FeS、Fe组成 |
考点:有关混合物反应的计算
专题:计算题
分析:铁与硫反应生成FeS,硫化亚铁与盐酸反应生成硫化氢气体,当铁粉不足时,气体只有硫化氢;当铁粉不足时,放出的气体为氢气和硫化氢,无论铁粉是否过量,生成气体的物质的量与铁粉的物质的量总是相等,据此进行判断.
解答:
解:标准状况下2.24L气体的物质的量为:
=0.1mol,
当铁粉过量或恰好反应时,生成气体为氢气和硫化氢的混合物,根据关系式Fe~H2、Fe~FeS~H2S可知,铁粉的物质的量与生成气体的物质的量相等,为0.1mol,混合物中的硫粉质量≤0.1mol,混合物质量≤56g/mol×0.1mol+32g/mol×0.1mol=8.8g;
当铁粉不足时,生成气体为硫化氢,根据Fe~FeS~H2S可知,铁粉的物质的量为0.1mol,质量为:56g/mol×0.1mol=5.6g,硫粉的质量大于:32g/mol×0.1mol=3.2g,则混合物总质量大于8.8g;
A.根据分析可知,原混合物中铁粉的物质的量为0.1mol,故A正确;
B.当硫粉过量时,混合物总质量大于8.8g,故B正确;
C.生成物组成需要根据反应物的过量情况分析,可能为硫化亚铁,也可能为铁和FeS的化合物,故C错误;
D.根据C的分析可知,加热后的混合物可能只有FeS,故D错误;
故选A.
| 2.24L |
| 22.4L/mol |
当铁粉过量或恰好反应时,生成气体为氢气和硫化氢的混合物,根据关系式Fe~H2、Fe~FeS~H2S可知,铁粉的物质的量与生成气体的物质的量相等,为0.1mol,混合物中的硫粉质量≤0.1mol,混合物质量≤56g/mol×0.1mol+32g/mol×0.1mol=8.8g;
当铁粉不足时,生成气体为硫化氢,根据Fe~FeS~H2S可知,铁粉的物质的量为0.1mol,质量为:56g/mol×0.1mol=5.6g,硫粉的质量大于:32g/mol×0.1mol=3.2g,则混合物总质量大于8.8g;
A.根据分析可知,原混合物中铁粉的物质的量为0.1mol,故A正确;
B.当硫粉过量时,混合物总质量大于8.8g,故B正确;
C.生成物组成需要根据反应物的过量情况分析,可能为硫化亚铁,也可能为铁和FeS的化合物,故C错误;
D.根据C的分析可知,加热后的混合物可能只有FeS,故D错误;
故选A.
点评:本题考查了混合物反应的计算,题目难度中等,注意掌握讨论法在化学计算中的应用方法,正确判断生成物组成为解答关键,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
 高炉炼铁中发生的基本反应之一如下:FeO(固)+CO(气)?Fe(固)+CO2(气)(△H>0).
高炉炼铁中发生的基本反应之一如下:FeO(固)+CO(气)?Fe(固)+CO2(气)(△H>0). 汽车尾气净化器中的主要反应为:2NO(g)+2CO(g)
汽车尾气净化器中的主要反应为:2NO(g)+2CO(g)
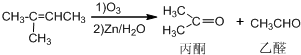
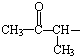 、且属于酯类的同分异构体:
、且属于酯类的同分异构体:
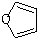 )也可以发生“Diels-Alder反应”,该化学反应方程式为:
)也可以发生“Diels-Alder反应”,该化学反应方程式为: 由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀,若用如图所示实验装置可制得纯净的Fe(OH)2沉淀.两极材料分别为石墨和铁.
由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀,若用如图所示实验装置可制得纯净的Fe(OH)2沉淀.两极材料分别为石墨和铁. 几种常见物质之间存在如图转化关系,其中X、Y、Z为单质,且X为生活中最常用金属,其他物质均为化合物.已知Y 为无色无味气体,E 为无色有刺激性气味气体,能使品红溶液退色,G溶液呈黄色,它们之间(部分产物及条件略去).请回答下列问题:
几种常见物质之间存在如图转化关系,其中X、Y、Z为单质,且X为生活中最常用金属,其他物质均为化合物.已知Y 为无色无味气体,E 为无色有刺激性气味气体,能使品红溶液退色,G溶液呈黄色,它们之间(部分产物及条件略去).请回答下列问题: