题目内容
已知c(NH4Cl)小于0.1mol/L时,溶液的pH>5.1,现用0.1mol/LHCl滴定10mL0.05mol/L氨水,用甲基橙作指示剂(变色范围为3.1~4.4),达到终点所用盐酸( )
| A、10mL | B、5mL |
| C、大于5mL | D、小于5mL |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:按照酸碱恰好中和反应进行计算,可知需消耗盐酸体积为5ml,依据题干信息可知,此时溶液pH值大于5.1,而甲基橙的变色范围在3.1-4.4范围,不变色,故应继续向其中滴加盐酸方可发生变色.
解答:
解:按照酸碱恰好中和反应进行计算,可知需消耗盐酸体积为5ml,依据题干信息可知,此时溶液pH值大于5.1,而甲基橙的变色范围在3.1-4.4范围,不变色,故应继续向其中滴加盐酸方可发生变色,所以终点时所用盐酸的量应大于5mL,故选:C.
点评:本题主要考查了酸碱中和反应,指示剂的选择对测定结果的影响,难度中等,注意变色范围.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
下列实验过程中,溶液始终无明显现象发生的是( )
| A、NO2通入FeSO4溶液中 |
| B、CO2通入CaCl2溶液中 |
| C、NH3通入AlCl3溶液中 |
| D、SO2通入酸性KMnO4溶液中 |
用NA表示阿伏加德罗常数的值.下列叙述中正确的是( )
| A、常温常压下42g 乙烯和丁烯混合气体中,极性键数为6NA |
| B、100 mL 0.1 mol?L-1 Na2CO3溶液中,离子总数是0.03NA |
| C、标准状况下,11.2L的O2和NO的混合物含有的分子数约为0.5×6.02×1023 |
| D、6.4g SO2与足量氧气反应生成SO3,转移电子数为0.2NA |
有机物A是衡量一个国家石油工业是否发达的标志性物质,A在催化剂作用与水反应的产物为B,B可与食醋中的有机酸C发生反应生成D,下列说法中正确的是( )
| A、实验室制取D时,使用水浴加热 |
| B、A能与溴水和酸性KMnO4溶液发生氧化还原反应,而使它们褪色 |
| C、D的同分异构体中含有羧基的有3种 |
| D、B和C的熔点和沸点都比C2H6、C2H4的沸点和熔点高 |
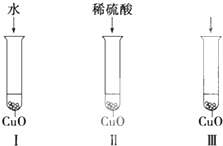 氧化铜是一种黑色固体,可溶于稀硫酸.某同学想知道是稀硫酸的哪种粒子(H2O、H+、SO42-)能使氧化铜溶解.请你和他一起通过下图所示Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动.
氧化铜是一种黑色固体,可溶于稀硫酸.某同学想知道是稀硫酸的哪种粒子(H2O、H+、SO42-)能使氧化铜溶解.请你和他一起通过下图所示Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动.