题目内容
1.A、B、C、D、E、F为原子序数依次增大的同周期的主族元素,已知A、C、F三原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,D元素原子的最外层电子数比次外层电子数少4,E元素原子次外层电子数比最外层电子数多3.请回答下列问题:(1)写出下列元素的符号:BMg、DSi、EP.
(2)写出B、F形成化合物的电子式
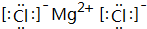 .
.(3)A、C两种元素最高价氧化物的水化物反应的离子方程式:Al(OH)3+OH-═AlO2-+2H2O.
分析 A、B、C、D、E、F为原子序数依次增大的同周期的主族元素,D元素的最外层电子数比次外层电子数少4,D原子只能有3个电子层,原子最外层电子数为8-4=4,则D为Si元素;元素均处于第三周期,E元素原子次外层电子数比最外层电子数多3,最外层电子数为8-3=5,则E为磷元素;A、C、F三种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,则含有Al元素,氢氧化铝溶于强酸、强碱,故有Na元素,则A为Na、C为Al,三种原子最外层共有11个电子,则F的最外层电子数为11-1-3=7,则F为Cl元素,结合原子序数可知B为Mg,据此解答.
解答 解:(1)A、B、C、D、E、F为原子序数依次增大的同周期的主族元素,D元素的最外层电子数比次外层电子数少4,D原子只能有3个电子层,原子最外层电子数为8-4=4,则D为Si元素;元素均处于第三周期,E元素原子次外层电子数比最外层电子数多3,最外层电子数为8-3=5,则E为磷元素;A、C、F三种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,则含有Al元素,氢氧化铝溶于强酸、强碱,故有Na元素,则A为Na、C为Al,三种原子最外层共有11个电子,则F的最外层电子数为11-1-3=7,则F为Cl元素,结合原子序数可知B为Mg,
故答案为:Mg;Si;P;
(2)B、F形成化合物为MgCl2,电子式为: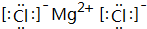 ,故答案为:
,故答案为: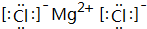 ;
;
(3)A、C两种元素最高价氧化物的水化物之间反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O.
点评 本题考查结构性质位置关系、常用化学用语等,难度不大,注意基础知识的理解掌握,推断元素是解题的关键.

练习册系列答案
 全程金卷系列答案
全程金卷系列答案 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
11.某原电池装置如图所示,盐桥中装有用饱和氯化钾溶液浸泡过的琼脂.下列叙述正确的是( )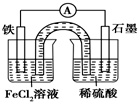

| A. | 原电池工作一段时间后,FeCl2溶液中c(Cl-)增大 | |
| B. | 此电池工作原理与硅太阳能电池工作原理相同 | |
| C. | Fe为正极,石墨上发生的反应为2H++2e-═H2↑ | |
| D. | 该装置中的盐桥完全可用金属导线代替 |
9.下列有关实验操作能达到相应目的是( )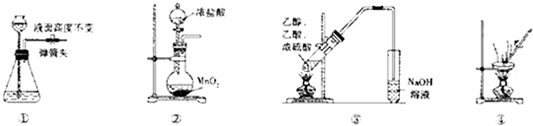

| A. | 装置①所示气密性良好 | |
| B. | 装置②可用于实脸室制取氯气 | |
| C. | 装置③可用于制取并收集乙酸乙脂 | |
| D. | 装置④可用于除去硫酸铜晶体中的结晶水 |
16.如图曲线a和b是盐酸与氢氧化钠相互滴定的滴定曲线,下列叙述正确的是( )


| A. | 盐酸的物质的量浓度为1mol/L | |
| B. | P点时恰好完全反应,溶液呈中性 | |
| C. | 曲线a是盐酸滴定氢氧化钠的滴定曲线 | |
| D. | 酚酞不能用作本实验的指示剂 |
6.下列气态氢化物中最稳定的是( )
| A. | H2O | B. | PH3 | C. | HF | D. | NH3 |
13.下列有关有机化合物的认识正确的是( )
| A. | 某烷烃命名为3-甲基-5-乙基己烷 | |
| B. | 用溴的CCl4溶液可鉴别己烷、2,4-己二烯和甲苯 | |
| C. | 酸性条件下CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH | |
| D. | 乙醇脱水制乙烯;溴乙烷消去制乙烯两者反应类型相同 |
11.某有机物的结构简式如下,关于该有机物的下列叙述不正确的是( )


| A. | 不能发生消去反应 | |
| B. | 能使溴水褪色 | |
| C. | 在加热和催化剂作用下,最多能与4 mol H2反应 | |
| D. | 一定条件下,能发生取代反应 |

 ⑥
⑥ ⑦CH3CH2CH3
⑦CH3CH2CH3 ⑨
⑨ ⑩
⑩
 的一氯取代物有2种
的一氯取代物有2种