题目内容
12.已知A、B、C、D、E、F是含有同一种元素的化合物,工业生产C的过程中有有一个步骤为F经催化氧化生成B和H2O,它们之间能发生如下反应:①A+H2O→B+C②C+F→D③D+NaOH$\stackrel{△}{→}$F+E+H2O.(1)写出下列物质的化学式:ANO2、DNH4NO3,
(2)写出反应①的离子方程式3NO2+H2O=2H++2NO3-+NO,并指出反应①的氧化剂和还原剂:氧化剂NO2、还原剂NO2,
(3)写出F经催化氧化生成B和水的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(4)氨气的制备与运输过程中都有严格要求.运输时,严禁与卤素(如Cl2)混装运输.若二者接触时剧烈反应产生白烟,若0.4molNH3参加反应时有0.3mol电子转移,写出反应的化学方程式8NH3+3Cl2=N2+6 NH4Cl.
分析 A、B、C、D、E、F是含有同一种元素的化合物,工业生成C的过程中F经催化氧化生成B和H2O,应是工业制备硝酸,则F是NH3,由③D+NaOH→F+E+H2O,说明D是铵盐,E为钠盐,且A、B、C、D、E、F是含有同一种元素的化合物,则E是NaNO3,D是NH4NO3,根据②C+F→D,可知C是HNO3,再根据①A+H2O→B+C,则A是NO2,B是NO,据此解答.
解答 解:A、B、C、D、E、F是含有同一种元素的化合物,工业生成C的过程中F经催化氧化生成B和H2O,应是工业制备硝酸,则F是NH3,由③D+NaOH→F+E+H2O,说明D是铵盐,E为钠盐,且A、B、C、D、E、F是含有同一种元素的化合物,则E是NaNO3,D是NH4NO3,根据②C+F→D,可知C是HNO3,再根据①A+H2O→B+C,则A是NO2,B是NO.
(1)通过以上分析知,A为NO2,D为NH4NO3,故答案为:NO2;NH4NO3;
(2)反应①是二氧化氮和水反应生成一氧化氮和硝酸,离子方程式为:3NO2+H2O=2H++2NO3-+NO,该反应中N元素化合价由+4价变为+2价和+5价,所以此反应中氧化剂NO2,还原剂是NO2,
故答案为:3NO2+H2O=2H++2NO3-+NO;NO2;NO2;
(3)NH3经催化氧化生成NO和H2O,反应方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(4)反应中氯气为氧化剂,Cl元素化合价由0价降低到-1价,反应生成白烟为NH4Cl,0.4molNH3参加反应时有0.3mol电子转移,参加反应的氯气为$\frac{0.3mol}{2}$=0.15mol,被氧化的N原子为0.4mol-0.15mol×2=0.1mol,被氧化的N元素在氧化产物中化合价a,则(a+3)×1mol=0.3mol,故a=0,则生成N2,所以方程式应为:8NH3+3Cl2=N2+6 NH4Cl,
故答案为:8NH3+3Cl2=N2+6 NH4Cl.
点评 本题考查无机物推断,涉及N元素化合物性质与转化,以F催化氧化为突破口进行推断,需要学生熟练掌握中学常见化学工业,难易适中,侧重对学生基础知识的巩固与训练.

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案| A. | Fe2O3固体可以用FeSO4溶液在蒸发皿中加热蒸干获得 | |
| B. | 可用碳酸氢铵溶液鉴别稀盐酸、氢氧化钠溶液、氯化铝溶液 | |
| C. | 用稀硝酸检验氢气还原氧化铜所生成的红色固体中含有氧化亚铜 | |
| D. | 测定相同条件下盐酸和磷酸溶液的pH,证明非金属性:Cl>P |
| A. | 氧元素的单质存在同素异形体 | B. | 微粒半径:O2->S2- | ||
| C. | 还原性:H2S<H2O | D. | 该反应中化学能全部转化为热能 |
(1)装置:

(2)试剂:a.NaOH溶液 b.澄清石灰水 c.浓硫酸 d.饱和NaHCO3溶液
e.碱石灰 f.品红溶液 g.湿润的红色石蕊试纸
| 制取气体 | 杂质气体 | 制取气体的发生装置 | 除去杂质气体的净化装置 | 收集装置 | 净化装置内 所用试剂 | 检验制得气体所用试剂 |
| NH3 | H2O(g) |
| A. | 10:1 | B. | 1:10 | C. | 2:1 | D. | 4:5 |


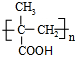
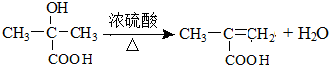
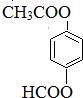 (只写一种)
(只写一种)
 OH$\stackrel{SOCl_{2}}{→}$R
OH$\stackrel{SOCl_{2}}{→}$R Cl
Cl
 ,⑥的反应类型是取代反应.
,⑥的反应类型是取代反应. .
. +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$ +HOCH2COONa+NaCl.
+HOCH2COONa+NaCl. .
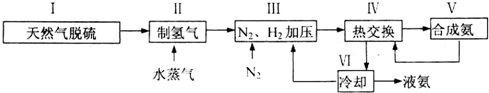
.
 ,写出再生反应的化学方程式:2NH4HS+O2$\frac{\underline{\;一定条件\;}}{\;}$2NH3•H2O+2S;NH3的沸点高于H2S,是因为NH3分子之间存在着一种叫分子间作用的作用力.
,写出再生反应的化学方程式:2NH4HS+O2$\frac{\underline{\;一定条件\;}}{\;}$2NH3•H2O+2S;NH3的沸点高于H2S,是因为NH3分子之间存在着一种叫分子间作用的作用力.
 的系统命名为2,3-二甲基丁烷;
的系统命名为2,3-二甲基丁烷;