题目内容
7.H2S在O2中不完全燃烧生成S和H2O.下列说法正确的是( )| A. | 氧元素的单质存在同素异形体 | B. | 微粒半径:O2->S2- | ||
| C. | 还原性:H2S<H2O | D. | 该反应中化学能全部转化为热能 |
分析 A.氧气、臭氧为氧元素的不同单质;
B.离子的电子层越多,离子半径越大;
C.H2S在O2中不完全燃烧生成S和H2O,S失去电子,H2S为还原剂;
D.燃烧放出能量,并发光发热.
解答 解:A.氧气、臭氧为氧元素的不同单质,二者互为同素异形体,故A正确;
B.离子的电子层越多,离子半径越大,则离子半径为O2-<S2-,故B错误;
C.H2S在O2中不完全燃烧生成S和H2O,S失去电子,H2S为还原剂,由还原剂的还原性大于还原产物的还原性可知,还原性:H2S>H2O,故C错误;
D.燃烧放出能量,并发光发热,则该反应中化学能不能完全转化为热能,故D错误;
故选A.
点评 本题以氧化还原反应为载体考查微粒性质、能量变化等,为高频考点,把握反应中元素的化合价变化及规律性知识的应用为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案
相关题目
17.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.现有一定量的铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中逐滴加入5mol/L NaOH溶液,所加的NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示,下列说法不正确的是( )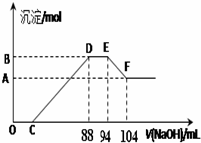

| A. | 稀硝酸与铝粉、铁粉反应,其还原产物为硝酸铵 | |
| B. | 图中C点对应溶液体积为48mL | |
| C. | 原硝酸溶液中含硝酸的物质的量为0.5mol | |
| D. | 样品中铝粉和铁粉的物质的量之比5:3 |
15.对于Zn(s)+H2SO4(aq)═ZnSO4(aq)+H2(g)△H<0 的化学反应下列叙述不正确的是( )
| A. |  反应过程中能量关系可用图表示 | |
| B. | 该反应为自发反应 | |
| C. | 若将该反应设计成原电池则锌为负极 | |
| D. | 若将其设计为原电池,当有32.5g锌溶解时,正极放出气体为11.2L |
2.化学与人类社会的生产、生活有着密切联系.下列叙述中正确的是( )
| A. | 苹果放在空气中久置变黄和纸张久置变黄原理相似 | |
| B. | 不法商家制取的“地沟油”具有固定的熔沸点 | |
| C. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 | |
| D. | 在家可用食醋代替CO2来增强漂白粉的漂白性 |
19.制备干燥的氨气所需的药品是( )
| A. | NH4Cl溶液,NaOH溶液 | B. | 浓NaOH溶液,NH4Cl晶体,浓H2SO4 | ||
| C. | 浓氨水,浓硫酸 | D. | NH4Cl固体,消石灰,碱石灰 |