题目内容
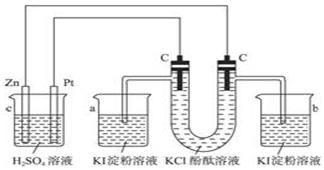
6.某溶液仅有K+、Al3+、Mg2+、NH4+、Cl-、SO42-、HCO3-中的几种.为确定其成分,做如下实验:①取部分溶液.加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀全部溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,无沉淀产生.下列推断正确的是( )| A. | 肯定有Al3+、Cl-,一定没有HCO3-和SO42- | |
| B. | 肯定有Al3+、Mg2+、Cl-,可能有NH4+、K+ | |
| C. | 肯定有Al3+、NH4+、Cl-,肯定没有HCO3- | |
| D. | 该溶液可能显弱酸性,也可能显中性 |
分析 ①取部分溶液.加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀全部溶解,可知一定不含Mg2+、NH4+,一定含Al3+,因铝离子与HCO3-相互促进水解,一定不存在HCO3-,气体为氧气;
②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,无沉淀产生,则一定不含SO42-,结合溶液为电中性为解答.
解答 解:由上述分析可知,一定不存在Mg2+、NH4+、SO42-、HCO3-,不能确定是否含K+,一定含阳离子为Al3+,由电荷守恒可知,一定含阴离子为Cl-,氯化铝溶液水解显酸性,
故选A.
点评 本题考查常见离子的检验,为高频考点,把握离子之间的反应、现象为解答的关键,侧重分析与推断能力的考查,注意电荷守恒的应用,题目难度不大.

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
16.下列有关方程式正确的是( )
| A. | 碳酸钠溶液呈碱性:CO32-+H2O?HCO3-+OH- | |
| B. | 碳酸溶液呈酸性:H2CO3?2H++CO32- | |
| C. | Cl2溶于水:Cl2+H2O?Cl-+ClO-+2H+ | |
| D. | 往有足量的碳酸镁固体的溶液中加入NaOH固体:Mg2++2OH-═Mg(OH)2(已知:Ksp(Mg(OH)2)>Ksp(MgCO3) |
17.短周期主族元素W、X、Y、Z的原子序数依次增大,W2-、X+离子具有相同电子层结构,Y的族序数比周期序数大1,W与Z同主族.下列说法正确的是( )
| A. | W与X只能形成一种化合物 | B. | X与Z形成的化合物其水溶液呈碱性 | ||
| C. | 氢化物的稳定性:W<Y<Z | D. | Y的最高价氧化物能与水反应 |
14.化学与社会、生活密切相关.对下列现象或事实的解释正确的选项是( )
| 选项 | 现象或事实 | 解释 |
| A | 臭氧能用于杀菌消毒 | 臭氧的还原性使细菌的蛋白质变性 |
| B | 铁能用于治疗缺铁性贫血 | 铁能与盐酸生成三氯化铁 |
| C | 过氧化钠作呼吸面具中的供氧剂 | 过氧化钠是强氧化剂,能氧化二氧化碳 |
| D | 用浸有酸性高锰酸钾的硅藻土作水果保鲜剂 | 高锰酸钾能氧化水果释放的催熟剂乙烯 |
| A. | A | B. | B | C. | C | D. | D |
1.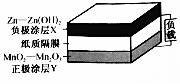 未来5-10年,可穿戴电池--纸质电池将用干诸多可穿戴设备上.某二次纸质电池的基本构造如图所示.下列有关该电池说法正确的是( )
未来5-10年,可穿戴电池--纸质电池将用干诸多可穿戴设备上.某二次纸质电池的基本构造如图所示.下列有关该电池说法正确的是( )
 未来5-10年,可穿戴电池--纸质电池将用干诸多可穿戴设备上.某二次纸质电池的基本构造如图所示.下列有关该电池说法正确的是( )
未来5-10年,可穿戴电池--纸质电池将用干诸多可穿戴设备上.某二次纸质电池的基本构造如图所示.下列有关该电池说法正确的是( )| A. | 放电电流由负极涂层经外电路流向正极涂层 | |
| B. | 充电时正极涂层与外接电源正极相连,发生还原反应 | |
| C. | 放电时每消耗65 g Zn通过纸质隔膜的电子为2 mol | |
| D. | 充电时阳极反应式为Mn2O3+2OH--2e-═2MnO2+H2O |
11.下列反应的离子方程式书写正确的是( )
| A. | 硫酸亚铁溶液中通入氯气 Fe2++Cl2═Fe3++Cl- | |
| B. | 碳酸镁跟稀硫酸反应:MgCO3+2H+═Mg2++H2O+CO2↑ | |
| C. | 石灰乳与稀盐酸反应OH-+H+═2H2O | |
| D. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ |
9.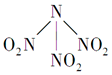 科学家最近研制出有望成为高效火箭推进剂的N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°,下列有关N(NO2)3的说法正确的是( )
科学家最近研制出有望成为高效火箭推进剂的N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°,下列有关N(NO2)3的说法正确的是( )
 科学家最近研制出有望成为高效火箭推进剂的N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°,下列有关N(NO2)3的说法正确的是( )
科学家最近研制出有望成为高效火箭推进剂的N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°,下列有关N(NO2)3的说法正确的是( )| A. | 分子中N、O间形成的共价键是非极性键 | |
| B. | 分子中4个氮原子共平面 | |
| C. | 该分子中的中心氮原子还有一对孤电子对 | |
| D. | 15.2 g该物质含有6.02×1022个原子 |