题目内容
16.下列离子中半径最小的是( )| A. | Na+ | B. | F- | C. | Al3+ | D. | O2- |
分析 具有相同电子层结构的不同离子,原子序数越小,半径越大,以此来解答.
解答 解:给出的离子中,具有相同电子层结构,具有相同电子层结构的不同离子,原子序数越小,半径越大,原子序数大小顺序为Al>Na>F>O,故半径最小的为Al3+,故选C.
点评 本题考查半径的比较,明确半径大小比较方法即可解答,题目较简单.

练习册系列答案
相关题目
7. 25℃时,三种酸的电离常数为:
25℃时,三种酸的电离常数为:
请回答下列问题:
(1)物质的量浓度为0.1mol/L的下列物质:a.Na2CO3、b.NaClO、c.CH3COONa、d.NaHCO3;pH由大到小的顺序是:abdc(填编号)
(2)常温下0.1mol/L的CH3COOH在水中约有1%发生电离,其溶液的pH=3,将该溶液加蒸馏水稀释,在稀释过程中,下列表达式的数据变大的是:BD.
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)•c(OH-) D.c(OH-)/c(H+)
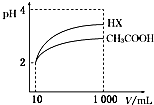
(3)体积为10mL pH=2的醋酸溶液与一元酸HX分别加蒸馏水稀释至1 000mL,稀释过程pH变化如图;则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;稀释后,HX溶液中水电离出来的c(H+)大于醋酸溶液水电离出来的c(H+)(填“大于”、“等于”或“小于”).
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中:c(CH3COO-)-c(Na+)=9.9×10-7mol/L(填准确数值).
 25℃时,三种酸的电离常数为:
25℃时,三种酸的电离常数为:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数K | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(1)物质的量浓度为0.1mol/L的下列物质:a.Na2CO3、b.NaClO、c.CH3COONa、d.NaHCO3;pH由大到小的顺序是:abdc(填编号)
(2)常温下0.1mol/L的CH3COOH在水中约有1%发生电离,其溶液的pH=3,将该溶液加蒸馏水稀释,在稀释过程中,下列表达式的数据变大的是:BD.
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)•c(OH-) D.c(OH-)/c(H+)
(3)体积为10mL pH=2的醋酸溶液与一元酸HX分别加蒸馏水稀释至1 000mL,稀释过程pH变化如图;则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;稀释后,HX溶液中水电离出来的c(H+)大于醋酸溶液水电离出来的c(H+)(填“大于”、“等于”或“小于”).
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中:c(CH3COO-)-c(Na+)=9.9×10-7mol/L(填准确数值).
8.五种元素X、Y、Z、W、M在周期表中位置关系如表,其中X、Y、Z、W是短周期元素,Z的气态氢化物与其低价氧化物能反应生成该元素单质的元素.下列说法正确的是( )
| X | Y | ||
| Z | W | ||
| M |
| A. | X、Y、Z、W形成的单质中都含有非极性共价键 | |
| B. | 元素最高价氧化物水化物对应的酸性大小W>Z,简单离子半径大小 关系:W>Z>X | |
| C. | M的氢化物的沸点高于X的,化合物M2O3有氧化性和还原性 | |
| D. | 有“海洋元素”美誉的元素与M同周期与W同主族 |
5.在强酸性溶液中能大量共存的离子组是( )
| A. | K+、Na+、NO3-、CO32- | B. | Ba2+、Na+、Cl-、SO42- | ||
| C. | K+、Na+、Cl-、NO3- | D. | Na+、Mg2+、OH-、NO3- |

 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O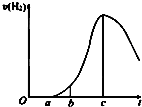 成都七中文艺青年小组进行了关于“活泼金属与酸反应”的实验,得出了一些有趣的想法,请你帮助他们,完成一些判断.将5.4g铝片投入500mL 0.5mol•L-1的硫酸溶液中,如图为反应产氢速率与反应时间的关系图.
成都七中文艺青年小组进行了关于“活泼金属与酸反应”的实验,得出了一些有趣的想法,请你帮助他们,完成一些判断.将5.4g铝片投入500mL 0.5mol•L-1的硫酸溶液中,如图为反应产氢速率与反应时间的关系图.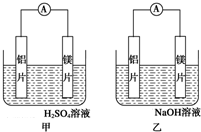 有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6mol•L-1的H2SO4溶液中,乙同学将电极放入6mol•L-1的NaOH溶液中,如图所示.
有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6mol•L-1的H2SO4溶液中,乙同学将电极放入6mol•L-1的NaOH溶液中,如图所示.