题目内容
13.用NA表示阿伏加德罗常数,下列说法中正确的是( )| A. | 在常温常压下,11.2 L氯气所含的原子数目为NA | |
| B. | 32g氧气含的原子数目为NA | |
| C. | 5.6g铁与足量盐酸反应生成标准状况下H2的体积为2.24L | |
| D. | 2L 0.1mol•L-1 K2SO4溶液中离子总数约为1.4NA |
分析 A、常温常压下,气体摩尔体积大于22.4L/mol;
B、氧气由氧原子构成;
C、求出铁的物质的量,然后根据反应后铁变为+2价来分析;
D、求出硫酸钾的物质的量,然后根据1mol硫酸钾中含3mol离子来分析.
解答 解:A、常温常压下,气体摩尔体积大于22.4L/mol,故11.2L氯气的物质的量小于0.5mol,则原子数小于NA个,故A错误;
B、氧气由氧原子构成,故32g氧气中含有的氧原子的物质的量n=$\frac{32g}{16g/mol}$=2mol,即2NA个,故B错误;
C、5.6g铁的物质的量为0.1mol,而反应后铁变为+2价,故0.1mol铁失去0.2mol电子,能将0.2mol氢离子还原为0.1mol氢气,在标况下体积为2.24L,故C正确;
D、溶液中硫酸钾的物质的量n=CV=0.1mol/L×2L=0.2mol,而1mol硫酸钾中含3mol离子,故由硫酸钾电离出的离子为0.6mol,即使再加上由水微弱电离出的氢离子和氢氧根,也要远小于1.4NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案
相关题目
3.碳和氮是动植物体中的重要组成元素,向大气中过度排放二氧化碳会造成温室效应,氮氧化物会产生光化学烟雾,目前,这些有毒有害气体的处理成为科学研究的重要内容.
(1)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)?N2(g)+CO2(g).
某研究小组向一个容器容积为3L且容积不变的密闭真空容器(固体试样体积忽略不计)中加入NO和足量的活性炭,在恒温(T1℃)条件下反应,测得不同时间(t)时各物质的物质的量(n)如表:
①0min~10min以v(N2)表示的反应速率为0.014mol/(L•min).
②根据表中数据,计算T1℃时该反应的平衡常数为0.56(保留两位小数).若某一时刻,容器中有1.2molC、1.2molNO、0.75molN2和1.08molCO2,此时v(正)=v(逆)(填“>、<、=”)
③下列各项能判断该反应达到平衡状态的是AC(填序号字母).
A.v(NO)(正)=2v(N2)(逆) B.容器内CO2和N2的体积比为1:1
C.混合气体的平均相对分子质量保持不变 D.容器内压强保持不变
④一定温度下,随着NO的起始浓度增大,则NO的平衡转化率不变(填“增大”、“不变”或“减小”).
(2)将水蒸气通过红热的碳即可产生水煤气.已知:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,C(s)+CO2(g)?2CO(g)△H=+172.5kJ•mol-1,则CO(g)+H2O(g)?CO2(g)+H2(g)的焓变△H=-41.2kJ•mol-1.
(3)在3L容积可变的密闭容器中发生上述反应:H2(g)+CO2(g)?H2O(g)+CO(g),恒温下c(CO)随反应时间t变化的曲线Ⅰ如图所示.
①若在t0时改变一个条件,使曲线Ⅰ变成曲线Ⅱ,则改变的条件是加入催化剂;
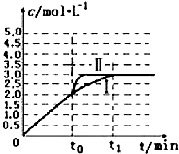
②若在t0时刻将容器体积快速压缩至2L(其他条件不变),请在图中画出c(CO)随反应时间t变化的曲线.
(1)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)?N2(g)+CO2(g).
某研究小组向一个容器容积为3L且容积不变的密闭真空容器(固体试样体积忽略不计)中加入NO和足量的活性炭,在恒温(T1℃)条件下反应,测得不同时间(t)时各物质的物质的量(n)如表:
| n/mol t/min | NO | N2 | CO2 |
| 0 | 2.00 | 0 | 0 |
| 10 | 1.16 | 0.42 | 0.42 |
| 20 | 0.80 | 0.60 | 0.60 |
| 30 | 0.80 | 0.60 | 0.60 |
②根据表中数据,计算T1℃时该反应的平衡常数为0.56(保留两位小数).若某一时刻,容器中有1.2molC、1.2molNO、0.75molN2和1.08molCO2,此时v(正)=v(逆)(填“>、<、=”)
③下列各项能判断该反应达到平衡状态的是AC(填序号字母).
A.v(NO)(正)=2v(N2)(逆) B.容器内CO2和N2的体积比为1:1
C.混合气体的平均相对分子质量保持不变 D.容器内压强保持不变
④一定温度下,随着NO的起始浓度增大,则NO的平衡转化率不变(填“增大”、“不变”或“减小”).
(2)将水蒸气通过红热的碳即可产生水煤气.已知:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,C(s)+CO2(g)?2CO(g)△H=+172.5kJ•mol-1,则CO(g)+H2O(g)?CO2(g)+H2(g)的焓变△H=-41.2kJ•mol-1.
(3)在3L容积可变的密闭容器中发生上述反应:H2(g)+CO2(g)?H2O(g)+CO(g),恒温下c(CO)随反应时间t变化的曲线Ⅰ如图所示.
①若在t0时改变一个条件,使曲线Ⅰ变成曲线Ⅱ,则改变的条件是加入催化剂;

②若在t0时刻将容器体积快速压缩至2L(其他条件不变),请在图中画出c(CO)随反应时间t变化的曲线.
1.将一定量的镁和铜组成的混合物加入到稀硝酸中,金属完全溶解(假设反应中还原产物只有NO).向反应后的溶液中加入3mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g.下列叙述不正确的是( )
| A. | 当金属全部溶解时收集到NO气体的体积一定为2.24 L | |
| B. | 当生成的沉淀量达到最大时,消耗NaOH溶液的体积V≥100mL | |
| C. | 参加反应的金属的总质量3.6g<m<9.6 g | |
| D. | 当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4 mol |
8.对氨基苯甲酸可用甲苯为原料合成,已知苯环上的硝基可被还原为氨基: +3Fe+6HCl→
+3Fe+6HCl→ +3FeCl2+2H2O,产物苯胺还原性强,易被氧化,则由甲苯合成对氨基苯甲酸的步骤合理的是( )
+3FeCl2+2H2O,产物苯胺还原性强,易被氧化,则由甲苯合成对氨基苯甲酸的步骤合理的是( )
 +3Fe+6HCl→
+3Fe+6HCl→ +3FeCl2+2H2O,产物苯胺还原性强,易被氧化,则由甲苯合成对氨基苯甲酸的步骤合理的是( )
+3FeCl2+2H2O,产物苯胺还原性强,易被氧化,则由甲苯合成对氨基苯甲酸的步骤合理的是( )| A. | 甲苯$\stackrel{硝化}{→}$X$\stackrel{氧化甲基}{→}$Y$\stackrel{还原硝基}{→}$对氨基苯甲酸 | |
| B. | 甲苯$\stackrel{氧化甲基}{→}$X$\stackrel{硝化}{→}$Y$\stackrel{还原硝基}{→}$对氨基苯甲酸 | |
| C. | 甲苯$\stackrel{还原}{→}$X$\stackrel{氧化甲基}{→}$Y$\stackrel{硝化}{→}$对氨基苯甲酸 | |
| D. | 甲苯$\stackrel{硝化}{→}$X$\stackrel{还原硝基}{→}$Y$\stackrel{氧化甲基}{→}$对氨基苯甲酸 |
18.设NA为阿伏加德罗常数,下列叙述正确的是(Fe 56、C 12、O 16)( )
| A. | 1mol•L-1NaHCO3溶液中的Na+数为NA | |
| B. | 常温时,4.4gCO2所含的氧原子数为0.2NA | |
| C. | 5.6g Fe与足量稀硝酸反应,转移电子数为0.2NA | |
| D. | 1molNa 与O2 反应生成Na2O2和Na2O电子转移数为0.1NA |
3.以下是25℃时几种难溶电解质的溶解度:
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些杂质离子.例如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可.
请回答下列问题:
(1)上述三种除杂方案都能够达到很好的效果,Fe3+、Fe2+都被转化为Fe(OH)3(填化学式)而除去.
(2)①中加入的试剂应该选择氨水为宜,其原因是不会引进新的杂质.
(3)②中除去Fe3+所发生的总反应的离子方程式为2Fe3++3Mg(OH)2=3Mg2++2Fe(OH)3.
(4)下列与方案③相关的叙述中,正确的是ACDE(填字母).
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在.
| 难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可.
请回答下列问题:
(1)上述三种除杂方案都能够达到很好的效果,Fe3+、Fe2+都被转化为Fe(OH)3(填化学式)而除去.
(2)①中加入的试剂应该选择氨水为宜,其原因是不会引进新的杂质.
(3)②中除去Fe3+所发生的总反应的离子方程式为2Fe3++3Mg(OH)2=3Mg2++2Fe(OH)3.
(4)下列与方案③相关的叙述中,正确的是ACDE(填字母).
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在.

 甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是通电后,将Co2+氧化成Co3+,然后以Co3+作氧化剂把水中的甲醇氧化成CO2而净化.实验室用如图装置模拟上述过程:
甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是通电后,将Co2+氧化成Co3+,然后以Co3+作氧化剂把水中的甲醇氧化成CO2而净化.实验室用如图装置模拟上述过程: