题目内容
将1.12g铁粉加入到25mL2mol?L-1的氯化铁溶液中,充分反应后,其结果是( )
| A、铁有剩余 |
| B、反应中氧化产物与还原产物的质量之比为2:5 |
| C、往溶液滴入KSCN溶液显红色 |
| D、溶液中的Fe2+和Fe3+的物质的量之比为1:6 |
考点:化学方程式的有关计算
专题:
分析:铁粉的物质的量为
=0.02mol,氯化铁的物质的量为2mol?L-1×0.025L=0.05mol,铁粉与氯化铁的离子反应方程式为:Fe+2Fe3+=3Fe2+,根据方程式可知,0.02molFe完全反应需要Fe3+的物质的量为0.02mol×2=0.04mol<0.05mol,故Fe完全反应,Fe3+有剩余,则生成Fe2+为0.02mol×3=0.06mol,剩余Fe3+为0.05mol-0.04mol=0.01mol,据此解答.
| 1.12g |
| 56g/mol |
解答:
解:铁粉的物质的量为
=0.02mol,氯化铁的物质的量为2mol?L-1×0.025L=0.05mol,铁粉与氯化铁的离子反应方程式为:Fe+2Fe3+=3Fe2+,根据方程式可知,0.02molFe完全反应需要Fe3+的物质的量为0.02mol×2=0.04mol<0.05mol,故Fe完全反应,Fe3+有剩余,则生成Fe2+为0.02mol×3=0.06mol,剩余Fe3+为0.05mol-0.04mol=0.01mol,
A.由上述分析可知,Fe完全反应,Fe3+有剩余,故A错误;
B.离子反应方程式为:Fe+2Fe3+=3Fe2+,氧化产物与还原产物的质量之比为1:2,故B错误;
C.由上述分析可知,Fe3+有剩余,往溶液滴入KSCN溶液显红色,故C正确;
D.溶液中的Fe2+和Fe3+的物质的量之比约是0.06mol:0.01mol=6:1,故D错误,
故选C.
| 1.12g |
| 56g/mol |
A.由上述分析可知,Fe完全反应,Fe3+有剩余,故A错误;
B.离子反应方程式为:Fe+2Fe3+=3Fe2+,氧化产物与还原产物的质量之比为1:2,故B错误;
C.由上述分析可知,Fe3+有剩余,往溶液滴入KSCN溶液显红色,故C正确;
D.溶液中的Fe2+和Fe3+的物质的量之比约是0.06mol:0.01mol=6:1,故D错误,
故选C.
点评:本题考查化学方程式有关计算、氧化还原反应等,涉及铁盐与亚铁盐的转化,关键是进行过量计算,注意已知两种反应物的量时,要考虑过量情况,难度中等.

练习册系列答案
相关题目
 向1L密闭容器中加入I2和
向1L密闭容器中加入I2和 各0.1mol,在一定条件下,发生反应:I2(g)+
各0.1mol,在一定条件下,发生反应:I2(g)+ (g)?
(g)? (g)+2HI(g)△H>0 测得体系中n(I2)随时间t变化如图所示,下列有关说法错误的是( )
(g)+2HI(g)△H>0 测得体系中n(I2)随时间t变化如图所示,下列有关说法错误的是( )A、单位时间内生成等物质的量的 和 和 时,反应达到平衡 时,反应达到平衡 |
| B、0-10min内生成HI的反应速率0.0088mol.L-1.min-1 |
C、10min时, 的转化率为44.0% 的转化率为44.0% |
| D、t1后图线变化可能是反应体系温度升高所致 |
室温时,20ml某气态烃与过量的氧气混合,完全燃烧后的产物通过浓H2SO4,再回复到室温,气体体积减少了50ml,剩余气体再通过苛性钠溶液,体积又减少了40ml.则该气态烃的分子式为( )
| A、CH4 |
| B、C2H4 |
| C、C3H6 |
| D、C2H6 |
银锌纽扣电池工作时的反应为:Zn+Ag2O+H2O=Zn(OH)2+2Ag,下列说法不正确的是( )
| A、锌是阴极,Ag2O是阳极 |
| B、电解质溶液为碱溶液,不可能是强酸溶液 |
| C、锌电极的反应式为:Zn+2OH--2e-=Zn(OH)2 |
| D、若工作时转移电子0.2mol,则消耗Zn的质量为6.5g |
下列化学式中只能表示一种物质的是( )
| A、C3H7Cl |
| B、P |
| C、C2H6O |
| D、CF2Cl2 |
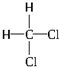 和
和
 和
和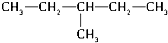
 CH2=CH-CH2CH3 和 CH3-CH=CH-CH3
CH2=CH-CH2CH3 和 CH3-CH=CH-CH3 纤维素与淀粉.
纤维素与淀粉. 某研究性学习小组通过查阅资料得到如下信息,乙醇在加热条件下可与HBr反应得到溴乙烷(CH3CH2Br),二者某些物理性质如表所示.
某研究性学习小组通过查阅资料得到如下信息,乙醇在加热条件下可与HBr反应得到溴乙烷(CH3CH2Br),二者某些物理性质如表所示. 某研究性学习小组为合成1丙醇,查阅资料得知一条合成路线:
某研究性学习小组为合成1丙醇,查阅资料得知一条合成路线: