题目内容
16.某固体混合物可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的两种或多种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积),关于该固体混合物,下列说法正确的是( )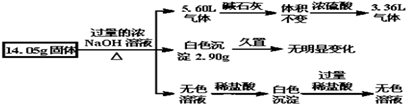
| A. | 一定含有Al,其物质的量为$\frac{5}{3}$mol | |
| B. | 一定不含FeCl2,可能含有MgCl2和AlCl3 | |
| C. | 一定含有(NH4)2SO4和FeCl2 | |
| D. | 一定含有(NH4)2SO4和MgCl2,且物质的量相等 |
分析 14.05g固体加入过量的氢氧化钠溶液产生气体,有铵盐和碱反应生成生成的氨气,也可以是金属铝与氢氧化钠溶液反应生成氢气,5.60L气体通过碱石灰无变化,说明气体中无与碱石灰反应的气体,无水蒸气的存在,通过浓硫酸,气体剩余3.36L,体积减少5.60L-3.36L=2.24L,结合混合物可能存在的物质可知,一定含有硫酸铵与氢氧化钠反应生成氨气为2.24L,剩余的气体只能是氢气,体积为3.36L,说明原混合物中一定含有铝;
14.05g固体加入过量的氢氧化钠溶液中产生白色沉淀2.9g,久置无变化,由于氢氧化铝溶于强碱,所以能生成白色沉淀的一定氯化镁生成的氢氧化镁白色沉淀,质量为2.90g,一定不存在FeCl2;
14.05g固体加入过量的氢氧化钠溶液得到无色溶液,加入适量盐酸会生成沉淀,说明金属铝或氯化铝与过量碱反应生成的偏铝酸钠与盐酸反应生成的氢氧化铝沉淀,加入过量盐酸沉淀溶解进一步证明沉淀是氢氧化铝,以此解答该题.
解答 解:14.05g固体加入过量的氢氧化钠溶液产生气体,有铵盐和碱反应生成生成的氨气,也可以是金属铝与氢氧化钠溶液反应生成氢气,5.60L气体通过碱石灰无变化,说明气体中无与碱石灰反应的气体,无水蒸气的存在,通过浓硫酸,气体剩余3.36L,体积减少5.60L-3.36L=2.24L,结合混合物可能存在的物质可知,一定含有硫酸铵与氢氧化钠反应生成氨气为2.24L,物质的量=$\frac{2.24L}{22.4L/mol}$=0.1mol,则(NH4)2SO4物质的量为0.05mol,剩余的气体只能是氢气,体积为3.36L,说明原混合物中一定含有铝;
14.05g固体加入过量的氢氧化钠溶液中产生白色沉淀2.9g,久置无变化,由于氢氧化铝溶于强碱,所以能生成白色沉淀的一定氯化镁生成的氢氧化镁白色沉淀,质量为2.90g,物质的量=$\frac{2.90g}{58g/mol}$=0.05mol,氢氧化铜为蓝色沉淀,所以固体混合物中一定不存在FeCl2;
14.05g固体加入过量的氢氧化钠溶液得到无色溶液,加入适量盐酸 会生成沉淀,说明金属铝或氯化铝与过量碱反应生成的偏铝酸钠与盐酸反应生成的氢氧化铝沉淀,加入过量盐酸沉淀溶解进一步证明沉淀是氢氧化铝,
A.固体混合物中一定含有Al,可以根据标况下3.36L氢气可以计算出铝的物质的量为0.1mol,故A错误;
B.根据以上分析可知,固体混合物中一定含有MgCl2,故B错误;
C.根据加入氢氧化钠溶液后生成白色沉淀,且白色沉淀没有变化,则固体混合物中一定含有MgCl2,一定不含FeCl2,故C错误;
D.根据以上分析可知,原固体混合物中一定含有(NH4)2SO4、MgCl2,上述计算可知二者物质的量相等,故D正确;
故选D.
点评 本题综合考查物质的检验和鉴别的实验方案的设计和评价,侧重于物质化学性质的综合应用,注意把握相关物质的性质以及反应现象,结合生成物物质的质量以及反应现象进行推断,题目难度中等.

| A. | ①③⑤ | B. | ②③⑤ | C. | ①④⑥ | D. | ③④⑤ |
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO | H2 | |||
| i | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| ii | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| iii | 900 | a | b | c | d | t |
②若a=2,b=1,则c=0.6,达平衡时实验组ii中H2O(g)和实验组iii中CO的转化率的关系为αii (H2O)=αiii (CO)(填“<”、“>”或“=”).
(2)CO分析仪的传感器可测定汽车尾气是否符合排放标准,该分析仪的工作原理类似于
燃料电池,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,能传导O2-.
①则负极的电极反应式为CO+2O2--2e-=CO32-.
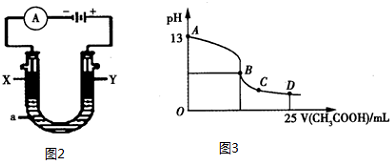
②以上述电池为电源,通过导线连接成图2.若X、Y为石墨,a为2L 0.1mol/L KCl溶液,写出电解总反应的离子方程式2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-.电解一段时间后,取25mL上述电解后的溶液,滴加0.4mol/L醋酸得到图3曲线(不考虑能量损失和气体溶于水,溶液体积变化忽略不计).根据图二计算,上述电解过程中消耗一氧化碳的质量为2.8g.
| A. | 加少量CH3COONa固体 | B. | 加水 | ||
| C. | 加少量CuSO4固体 | D. | 加等量等浓度Na2SO4溶液 |
| A. | 核内质子数 | B. | 核外电子数 | C. | 核外电子层数 | D. | 最外层电子数 |
| A. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| B. | 工业粉尘中含有Pb、Cd、Cr、V、As等金属元素,过量摄入均对人体有害 | |
| C. | 用工业明胶制作用药胶囊,会导致过量Cr元素摄入人体而提高致癌风险 | |
| D. | 分光光度计通过测定溶液颜色分析反应物(或生成物)浓度变化,从而确定化学反应速率 |
| A. | ①② | B. | ①③ | C. | ②③ | D. | ③④ |
| A. | 1 mol/L Na2CO3溶液中的Na+数目为2NA | |
| B. | 电解Na2SO4饱和溶液,若生成2 NA个H2,一定生成NA个O2 | |
| C. | 常温常压下,46 g NO2的原子数为3NA | |
| D. | 1 mol NO,与H2O完全反应时转移的电子数为2NA |