题目内容
12.含Mg2+和A13+的物质的量之比为1:2 的MgC12 和AlCl3两种溶液,若使溶液中的Cl-完全沉淀,用去相同浓度的AgNO3溶液的体积比为( )| A. | 1:3 | B. | 1:2 | C. | 3:1 | D. | 3:2 |
分析 Mg2+和A13+的物质的量之比为1:2 的MgC12 和AlCl3两种溶液,根据Ag++Cl-═AgCl↓可知n(Cl-)=n(Ag+),溶液中含有氯离子的物质的量越大,消耗硝酸银溶液体积越大,据此进行解答.
解答 解:根据Ag++Cl-═AgCl↓可知n(Cl-)=n(Ag+),溶液中含有氯离子的物质的量越大,消耗硝酸银溶液体积越大,
含Mg2+和A13+的物质的量之比为1:2 的MgC12 和AlCl3两种溶液中氯离子的物质的量之比为(1×2):(2×3)=1:3,
则消耗相同浓度的AgNO3溶液的体积比为1:3,
故选A.
点评 本题考查了化学方程式的计算,题目难度不大,明确发生反应实质为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目
2.如图所示原电池装置中,电解质溶液为稀盐酸,下列有关叙述错误的是( )


| A. | 锌做正极发生还原反应 | |
| B. | 供电时的总反应为:Zn+2H+=Zn2++H2 | |
| C. | 该装置可实现化学能转化为电能 | |
| D. | 产生1molH2,消耗锌的质量65g |
4.下列反应中,最终生成沉淀的是( )
| A. | 向氢氧化钠溶液中滴入硫酸铝溶液至过量 | |
| B. | 向偏铝酸钠溶液中滴入盐酸至过量 | |
| C. | 向氯化铝溶液中滴入氢氧化钠溶液至过量 | |
| D. | 向偏铝酸钠溶液中滴入氢氧化钠溶液至过量 |
1.在给定的条件下,下列选项所示的物质间转化均能实现的是( )
| A. | N2$\stackrel{O_{2}}{→}$NO2$?_{Cu}^{H_{2}O}$HNO3 | |
| B. | Fe$\stackrel{HCl}{→}$FeCl2$?_{Fe}^{HCl}$FeCl3 | |
| C. | C$→_{点燃}^{O_{2}}$CO$?_{C,高温}^{O_{2},点燃}$CO2 | |
| D. | AgNO3(aq)$\stackrel{NH_{3}•H_{2}O}{→}$[Ag(NH3)2]OH(aq)$→_{△}^{蔗糖}$Ag |
2.按照下列操作配出的溶液,物质的量浓度是1mol/L的是( )
| A. | 将53gNa2CO3溶于水配成500mL溶液 | |
| B. | 将40g氢氧化钠溶于1L水中 | |
| C. | 将1L10mol/L的NaCl溶液溶于9L水中 | |
| D. | 将22.4LHCl溶于水配成1L溶液 |


 .
.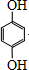 .
.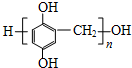 .
.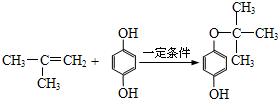 .
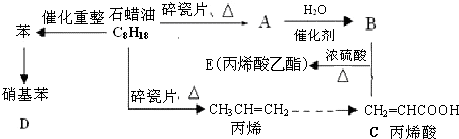
.
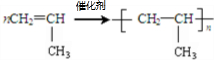 ;反应类型加聚反应.
;反应类型加聚反应.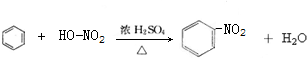 ;反应类型取代反应.
;反应类型取代反应.