题目内容
13.硼及其化合物在生产生活中有着重要的应用.(1)硼酸(H3BO3)是一元弱酸,在水溶液中会电离产生[B(OH)4]-离子,写出硼酸的电离方程式H3BO3+H2O?B(OH)4-+H+.
(2)硼砂化学式为Na2B4O7•l0H2O,生产硼砂时的废渣是硼镁泥,其主要成分是MgO,还含有CaO、Al2O3、Fe2O3、FeO、MnO、B2O3、SiO2等杂质.以硼镁泥为原料制取的七水硫酸镁在印染、造纸和医药等工业上都有广泛的应用.硼镁泥制取七水硫酸镁的工艺流程如下:
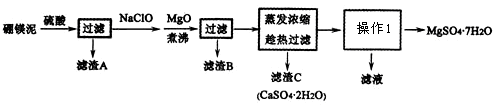
①硼酸与NaOH溶液反应可制得硼砂,该反应不是(填“是”或“不是”)氧化还原反应.
②滤渣B中含有不溶于稀盐酸的黑色固体,则滤渣B除含有Al(OH)3之外还含有的成分有Fe(OH)3、MnO2(填化学式);写出稀硫酸酸浸后的滤液生成B中黑色固体的离子方程式Mn2++ClO-+H2O=MnO2↓+2H++Cl-.
③趁热过滤的目的是防止硫酸镁在温度降低时结晶析出.
④上述操作1为蒸发浓缩、冷却结晶.
(3)NaBH4-“万能还原剂”,其在酸性条件下不能稳定存在,会产生一种气体,该气体电子式为H:H.
(4)设计实验证明:非金属性:硼<碳向NaB(OH)4溶液中通入二氧化碳气体发生反应生成硼酸,说明碳酸酸性大于硼酸,证明碳的非金属性大于硼.
分析 硼镁泥主要成份是MgO,还有CaO、Al2O3、Fe2O3、FeO、MnO、B2O3、SiO2等杂质,加入硫酸,MgO、CaO、Al2O3、Fe2O3、FeO、MnO、B2O3都和硫酸反应,SiO2不与硫酸反应,次氯酸钠具有强氧化性,加入的NaClO可与Mn2+反应生成MnO2,把亚铁离子氧化成铁离子,加MgO调节pH,溶液pH升高,铁离子生成氢氧化铁沉淀,铝离子形成氢氧化铝沉淀,过滤,滤渣B含有Fe(OH)3、Al(OH)3、MnO2,蒸发浓缩滤液,趁热过滤,滤渣C为硫酸钙晶体,滤液中含镁离子,除钙后,只剩镁离子,蒸发冷却结晶得到硫酸镁晶体.
(1)由信息可知为一元酸,H3BO3电离除生成B(OH)4-外还生成H+;
(2)①H3BO3与NaOH溶液反应生成Na2B4O7•lOH2O;
②滤渣B含有Fe(OH)3、Al(OH)3、MnO2,黑色固体为二氧化锰;次氯酸钠具有强氧化性,加入的NaClO可与Mn2+反应生成MnO2;
③温度较高时硫酸镁不会析出;
④蒸发浓缩滤液,趁热过滤,滤渣C为硫酸钙晶体,滤液中含镁离子,除钙后,只剩镁离子,蒸发冷却结晶得到硫酸镁晶体;
(3)NaBH4“万能还原剂”,其在酸性条件下不能稳定存在,会产生一种气体,NaBH4+3H2O+HCl=H3BO3+4H2↑+NaCl;
(4)非金属性越强最高价氧化物对应水化物的酸性越强.
解答 解:(1)硼酸电离出四羟基和硼酸根和氢离子,方程式为:H3BO3+H2O?B(OH)4-+H+,
故答案为:H3BO3+H2O?B(OH)4-+H+;
(2)①H3BO3与NaOH溶液反应生成Na2B4O7•lOH2O,其反应方程式为:4H3BO3+2NaOH+3H2O=Na2B4O7•lOH2O,反应过程中无元素化合价的变化不是氧化还原反应,
故答案为:不是;
②滤渣B含有Fe(OH)3、Al(OH)3、MnO2,稀硫酸酸浸后的滤液生成B中黑色固体为二氧化锰,NaClO溶液在加热条件下将溶液中的Mn2+氧化成MnO2,反应的离子方程式为:Mn2++ClO-+H2O=MnO2↓+2H++Cl-,
故答案为:Fe(OH)3、MnO2;Mn2++ClO-+H2O=MnO2↓+2H++Cl-;
③温度较高时硫酸镁溶解度较大,硫酸钙的溶解度较小,温度越高,硫酸钙溶解度越小,可以采用蒸发浓缩,趁热过滤方法除去硫酸钙,可以防止硫酸镁在温度降低时结晶析出;
故答案为:防止硫酸镁在温度降低时结晶析出;
④蒸发浓缩滤液,趁热过滤,滤渣C为硫酸钙晶体,滤液中含镁离子,除钙后,只剩镁离子,蒸发冷却结晶得到硫酸镁晶体.
故答案为:蒸发浓缩、冷却结晶;
(3)NaBH4“万能还原剂”,其在酸性条件下不能稳定存在,会产生一种气体,NaBH4+3H2O+HCl=H3BO3+4H2↑+NaCl,生成的氢气电子式为:H:H,
故答案为:H:H;
(4)由H2CO 3制备H3BO3可说明碳酸酸性强于硼酸,进而推知碳的非金属性比硼强,可以用测定溶液PH值的方法判断溶液酸性强弱,向NaB(OH)4溶液中通入二氧化碳气体发生反应生成硼酸,说明碳酸酸性大于硼酸,证明碳的非金属性大于硼,故答案为:向NaB(OH)4溶液中通入二氧化碳气体发生反应生成硼酸,说明碳酸酸性大于硼酸,证明碳的非金属性大于硼.
点评 本题考查物质制备工艺流程,为高考常见题型,涉及物质的分离与提纯、对原理与条件控制分析、盐类水解等,关键是对工艺流程理解,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.

| A. | 5:3 | B. | 5:4 | C. | 1:1 | D. | 4:5 |
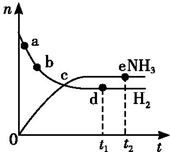 向绝热恒容密闭容器中通入N2和H2,在一定条件下使反应N2(g)+3H2(g)?2NH3(g)△H<0达到平衡,n(H2)和n(NH3)随时间变化的关系如图所示.下列有关叙述一定正确的是( )
向绝热恒容密闭容器中通入N2和H2,在一定条件下使反应N2(g)+3H2(g)?2NH3(g)△H<0达到平衡,n(H2)和n(NH3)随时间变化的关系如图所示.下列有关叙述一定正确的是( )| A. | c点表示NH3生成速率与NH3分解速率相等 | |
| B. | c点和e点H2的转化率相等 | |
| C. | 平衡后再升高温度,不利于氨的合成 | |
| D. | d点时:n(H2):n(NH3)=3:2 |
 常见的一硝基甲苯有对硝基甲苯和邻硝基甲苯两种,均可用于合成各种染料.某探究小组利用下列反应和装置制备一硝基甲苯.
常见的一硝基甲苯有对硝基甲苯和邻硝基甲苯两种,均可用于合成各种染料.某探究小组利用下列反应和装置制备一硝基甲苯.
实验中可能用到的数据:
| 密度/g?cm-3 | 沸点/℃ | 溶解性 | |
| 甲苯 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
| 对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
| 邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |
②在三颈瓶中加入13g甲苯(易挥发),按图1所示装好药品和其他仪器;
③向三颈瓶中加入混酸;
④控制水浴温度约为50℃,反应大约10min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯,经提纯最终得到纯净的一硝基甲苯共15g.
请回答下列问题:
(1)实验前需要在三颈瓶中加入少许沸石(或碎瓷片),目的是防止暴沸.
(2)冷凝管的作用是冷凝回流;冷却水从冷凝管的a(填“a”或“b”)端进入.
(3)仪器A的名称是分液漏斗,使用该仪器前必须进行的操作是检查是否漏液.
(4)分离反应后产物的方案如图2:

其中,操作1的名称为分液,操作2必需的玻璃仪器有酒精灯、温度计、锥形瓶、牛角管(尾接管)和蒸馏烧瓶、冷凝管.
(5)该实验中一硝基甲苯的产率为77.5%(保留三位有效数字).
| A. | 伴有能量变化的物质变化都是化学变化 | |
| B. | 吸热反应一定需要加热才能发生 | |
| C. | 凡是放热反应的发生均无需加热 | |
| D. | 物质发生化学反应都伴随着能量变化 |

