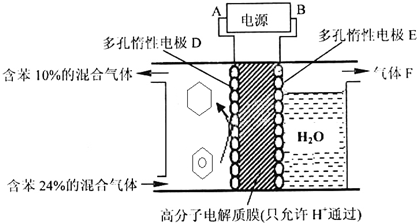
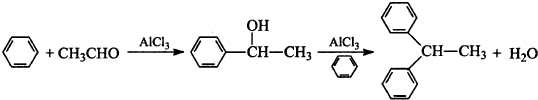
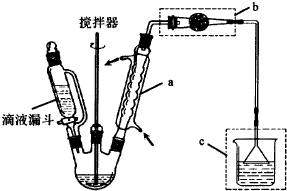
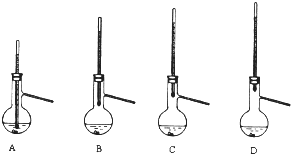
题目内容
20.某元素的原子核外有三个电子层,其最外层电子数是次外层电子数的一半,则此元素是( )| A. | Na | B. | Si | C. | P | D. | S |
分析 某元素的核外有三个电子层,最外层电子数是次外层电子数的一半,最外层电子数为4,核外电子排布为2、8、4,以此可确定元素种类.
解答 解:因某元素的原子核外有三个电子层,其最外层电子数是次外层电子数的一半,所以原子有三个电子层,每一层上的电子数分别为:2、8、4,原子序数为14,硅元素,故选:B.
点评 本题考查元素的核外电子排布规律,为高频考点,根据核外电子排布规律结合题意确定核外电子数,进而确定元素的名称,难度不大.

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
11.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 1 mol硫酸钾中阴离子所带电荷数为NA | |
| B. | 常温下,2.7克铝与足量的氢氧化钠溶液反应,失去的电子数为0.1NA | |
| C. | 在常温下,把100 g CaCO3加到1 L水中,所得溶液中的Ca2+数等于NA | |
| D. | 在标准状况下,22.4 L CH4与18 g H2O所含有的分子数均为NA |
15.下列各组离子能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式正确的是( )
| 选项 | 离子组 | 加入试剂 | 加入试剂后发生反应的离子方程式 |
| A | Fe2+、NO3-、NH4+ | NaHSO4溶液 | 3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O |
| B | Ca2+、HCO3-、Cl- | 少量NaOH溶液 | Ca2++2HCO3-+2OH-═2H2O+CaCO3↓+CO32- |
| C | K+、AlO2-、HCO3- | 通入少量CO2 | 2AlO2-+3H2O+CO2═2Al(0H)3↓+CO32- |
| D | NH4+、Al3+、SO42- | 少量Ba(OH)2 溶液 | 2 NH4++2SO42-+Ba2++2OH═BaSO42-+2NH3•H2O |
| A. | A | B. | B | C. | C | D. | D |
5.下列物质中,不含共价键的是( )
| A. | Na2S | B. | NH3 | C. | HClO | D. | Na2O2 |
12. 在一定温度下,容器内某一反应中,X、Y的物质在量随反应时间变化的曲线如图所示,下列表述中正确的是( )
在一定温度下,容器内某一反应中,X、Y的物质在量随反应时间变化的曲线如图所示,下列表述中正确的是( )
 在一定温度下,容器内某一反应中,X、Y的物质在量随反应时间变化的曲线如图所示,下列表述中正确的是( )
在一定温度下,容器内某一反应中,X、Y的物质在量随反应时间变化的曲线如图所示,下列表述中正确的是( )| A. | 反应的化学方程式为:2X?Y | B. | t2时,正逆反应速率相等,达到平衡 | ||
| C. | t1时,Y的浓度是X的2倍 | D. | t3时,正反应速率大于逆反应速率 |
9.实验证明,以下六种物质是一个氧化还原反应的反应物和生成物:NO、FeSO4、H2O、Fe(NO3)3、HNO3和Fe2(SO4)3下列说法错误的是( )
| A. | 该反应中氧化剂只有一种 | |
| B. | 该反应中还原产物只有一种 | |
| C. | 被氧化的元素一定是Fe元素 | |
| D. | 该反应中NO和Fe2(SO4)3的物质的量之比为2:3 |