题目内容
6.下列既属于正盐又属于含氧酸盐AEF,属于含氧酸的酸式盐的是BC,属于强酸强碱盐的是ACF,属于弱酸的酸式盐是B,属于复盐的是D.A.Na2SO4 B.NaHCO3 C.NaHSO4 D.KAl(SO4)2 E.CaCO3 F.NaCl.
分析 酸和碱恰好完全反应生成的盐为正盐,
多元酸和碱发生中和反应,酸部分反应生成的盐为酸式盐,
酸根阴离子中含氧元素的盐为含氧酸盐,
强酸和强碱发生中和反应生成的盐为强酸强碱盐,
多元弱酸和碱反应,酸部分中和生成的盐为弱酸的酸式盐,
含两种或两种以上金属阳离子,一种阴离子的盐为复盐,
依据物质组成、结构和概念分析判断.
解答 解:酸和碱恰好完全反应生成的盐为正盐,A.Na2SO4,E.CaCO3,F.NaCl符合正盐概念,
多元酸和碱发生中和反应,酸根阴离子中含氧元素的盐为含氧酸盐,酸部分反应生成的盐为含氧酸式盐,B.NaHCO3,C.NaHSO4 符合含氧酸式盐概念,
强酸和强碱发生中和反应生成的盐为强酸强碱盐,A.Na2SO4,C.NaHSO4,F.NaCl. 强酸和强碱反应生成的盐为强酸强碱盐,
多元弱酸和碱反应,酸部分中和生成的盐为弱酸的酸式盐,B.NaHCO3,
含两种或两种以上金属阳离子,一种阴离子的盐为复盐,D.KAl(SO4)2,
故答案为:AEF;BC;ACF;B;D.
点评 本题考查了物质分类的方法和物质名称、组成的理解应用,掌握概念实质是关键,题目较简单.

练习册系列答案
相关题目
16.下列物质对应的电子式书写正确的是( )
| A. | NH4Br: | B. | CaCl2: | ||
| C. | Na2O2: | D. | N2:N??N |
17.氢有三种同位素:$\stackrel{1}{1}$H、$\stackrel{2}{1}$H和$\stackrel{3}{1}$H,它们之间存在差异的是( )
| A. | 质子数 | B. | 中子数 | C. | 电子数 | D. | 原子序数 |
14.硼砂晶体由Na+、Xm-和H2O构成,它们之间存在的作用力有( )
| A. | 离子键 | B. | 共价键 | C. | 金属键 | D. | 范德华力 | ||||
| E. | 氢键 |
1.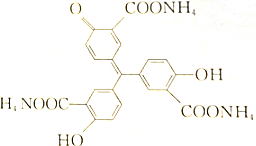 对于如图所示化合物,下列说法中错误的是( )
对于如图所示化合物,下列说法中错误的是( )
 对于如图所示化合物,下列说法中错误的是( )
对于如图所示化合物,下列说法中错误的是( )| A. | 该化合物的化学式为C22H23O9N3 | |
| B. | 分子内已有3个羧基被氨中和,故完全反应1mol该化合物还需2molNaOH | |
| C. | 该化合物可与FeCl3发生显色反应,不与银氨溶液反应 | |
| D. | 每1mol该化合物可与5molBr2反应 |
7.下列各组物质中,都含有共价键,却又都不属于共价化合物的一组( )
| A. | Na2O2 Na2O | B. | KClO NaOH | C. | Br2 HBr | D. | HF H2O |
4.下列微粒结构示意图正确且表示的是阳离子的是( )
| A. |  | B. |  | C. |  | D. |  |
5.下列说法正确的是( )
| A. | 6.02×1023称为阿伏加德罗常数 | |
| B. | 物质的量是用0.012千克碳中所含的原子数目作为标准来衡量其他微粒集体 | |
| C. | 标况下1mol氢气和氮气的混合气体的体积约为22.4L | |
| D. | 用单位体积的溶剂中所含溶质的物质的量表示溶液组成的物理量叫溶质的物质的量浓度 |