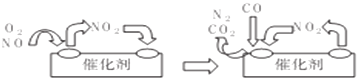
题目内容
1.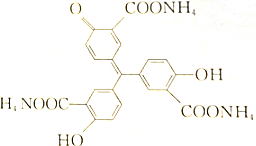 对于如图所示化合物,下列说法中错误的是( )
对于如图所示化合物,下列说法中错误的是( )| A. | 该化合物的化学式为C22H23O9N3 | |
| B. | 分子内已有3个羧基被氨中和,故完全反应1mol该化合物还需2molNaOH | |
| C. | 该化合物可与FeCl3发生显色反应,不与银氨溶液反应 | |
| D. | 每1mol该化合物可与5molBr2反应 |
分析 有机物含有酚羟基,可发生取代、氧化和显色反应,含有碳碳双键,可发生加成、加聚和氧化反应,为铵盐,可与碱反应,含有羰基,可发生加成反应,以此解答该题.
解答 解:A.由结构简式可知分子式为C22H23O9N3,故A正确;
B.分子中3个羧基被氨中和,可与氢氧化钠反应生成-COONa和氨气,且含有2个酚羟基,则完全反应1mol该化合物还需5molNaOH,故B错误;
C.含有酚羟基,可与氯化铁发生显色反应,不含醛基,与银氨溶液不反应,故C正确;
D.含有3个碳碳双键,可与溴发生加成反应,两个酚羟基的邻位可发生取代反应,则每1mol该化合物可与5molBr2反应,故D正确.
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意烯烃、酚以及铵盐的性质的性质,题目难度不大.

练习册系列答案
相关题目
11.下列符合中,表示2个氢分子的是( )
| A. | H2 | B. | 2H | C. | 2H2 | D. | 2H+ |
9.下列实验操作或事故处理中,正确的做法是( )
| A. | 稀释浓硫酸时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中 | |
| B. | 配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌 | |
| C. | 不慎将浓硝酸沾到皮肤上,立即用NaOH溶液冲洗 | |
| D. | 检测某溶液是否含有SO${\;}_{4}^{2-}$时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 |
16.pH=0的某溶液中还可能存在Al3+、Fe2+、NH4+、Ba2+、Cl-、CO32-、SO42-、NO3-中的若干种,现取适量溶液进行如下一系列实验:
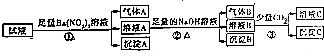
下列有关判断正确的是( )

下列有关判断正确的是( )
| A. | 试液中一定有Fe2+、SO42-、H+、NH4+、Al3+ | |
| B. | 试液中一定没有Ba2+、CO32-、NO3- | |
| C. | 步骤③中反应的离子方程式为:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| D. | 气体A、B之间肯定不能发生反应 |
2. 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.
请回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
(1)A2D2分子的电子式为 ,E的基态原子的外围电子排布式为3d24s2.
,E的基态原子的外围电子排布式为3d24s2.
(2)B、C、D三种元素的第一电离能由小到大的顺序为C<O<N.
(3)单质B与C的最高价氧化物的水化物的浓溶液微热反应,其化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
(4)下列叙述正确的是ad(填序号).
a. M是极性分子,N是非极性分子
b. M和BD2分子中的中心原子均采用sp2杂化
c. N分子中含有6个σ键和1个π键
d. BD2晶体的熔点、沸点都比二氧化硅晶体的低
(5)已知:①E的一种氧化物Q,其晶胞结构如图所示
①Q(s)+2Cl2(g)=ECl4(l)+D2(g)△H=+140kJ/mol
②2B(s)+D2(g)=2BD(g)△H=-221kJ/mol
写出物质Q和焦炭、氯气反应生成液态ECI4和BD气体的热化学方程式:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(l)+2CO(g)△H=-81kJ/mol
(6)在0.5L的密闭容器中,一定量的C2和A2进行如下化学反应:C2(g)+3A2(g)=2CA3(g)△H<0,其化学平衡常数K与温度t的关系如表.请回答下列问题.
①试比较K1,K2的大小,K1>K2(填写“>”、“=”或“<”).
②在400℃时,当测得CA3和C2、A2的物质的量分别为3mol和1mol、2mol时,则该反应的 V(C2)正>(C2)逆(填写“>”、“=”或“<”).
 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.请回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
(1)A2D2分子的电子式为
 ,E的基态原子的外围电子排布式为3d24s2.
,E的基态原子的外围电子排布式为3d24s2.(2)B、C、D三种元素的第一电离能由小到大的顺序为C<O<N.
(3)单质B与C的最高价氧化物的水化物的浓溶液微热反应,其化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
(4)下列叙述正确的是ad(填序号).
a. M是极性分子,N是非极性分子
b. M和BD2分子中的中心原子均采用sp2杂化
c. N分子中含有6个σ键和1个π键
d. BD2晶体的熔点、沸点都比二氧化硅晶体的低
(5)已知:①E的一种氧化物Q,其晶胞结构如图所示
①Q(s)+2Cl2(g)=ECl4(l)+D2(g)△H=+140kJ/mol
②2B(s)+D2(g)=2BD(g)△H=-221kJ/mol
写出物质Q和焦炭、氯气反应生成液态ECI4和BD气体的热化学方程式:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(l)+2CO(g)△H=-81kJ/mol
(6)在0.5L的密闭容器中,一定量的C2和A2进行如下化学反应:C2(g)+3A2(g)=2CA3(g)△H<0,其化学平衡常数K与温度t的关系如表.请回答下列问题.
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
②在400℃时,当测得CA3和C2、A2的物质的量分别为3mol和1mol、2mol时,则该反应的 V(C2)正>(C2)逆(填写“>”、“=”或“<”).
20.下列化学用语正确的是( )
| A. | 原子核内有8个中子的氧原子:18O | B. | Na2O的电子式: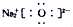 | ||
| C. | HClO 的结构式:H一CI一O | D. | F一的结构示意图: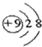 |