题目内容
16.下列说法中,不正确的是( )| A. | Cl2能与金属反应,生成高价金属盐 | |
| B. | 新制的氯水中加入AgNO3溶液,有白色沉淀生成 | |
| C. | 欲除去CO2中的大量HCl气体,可将此混合气体通过盛有饱和NaHCO3溶液的洗气瓶 | |
| D. | 漂白粉的有效成分是CaCl2和Ca(ClO)2,应密封保存 |
分析 A.变价金属被弱氧化剂氧化成低价态,被强氧化剂氧化成高价态;
B.新制氯水中氯气和水反应生成盐酸和次氯酸,溶液中氯离子结合银离子生成氯化银沉淀;
C.二氧化碳和碳酸氢钠溶液不反应,氯化氢极易溶于水;
D.漂白粉的有效成分是次氯酸钙,漂白粉中含有Ca(ClO)2,易与空气中的水和二氧化碳反应生成不稳定的HClO而变质.
解答 解:A.氯气具有强氧化性,氯气和变价金属发生反应生成高价金属的盐,如与Fe反应时Cl2能生成高价铁化合物,故A正确;
B.新制的氯水中氯气和水发生反应,Cl2+H2O?HCl+HClO,加入AgNO3溶液,HCl+AgNO3=AgCl↓+HNO3,有白色沉淀生成,故B正确;
C.欲除去CO2中的大量HCl气体,二氧化碳和碳酸氢钠溶液不反应,氯化氢极易溶于水,可将此混合气体通过盛有饱和NaHCO3溶液的洗气瓶可以洗去氯化氢,起到除杂作用,故C正确;
D.漂白粉的主要成分是次氯酸钙和氯化钙,有效成分是次氯酸钙,漂白粉中含有Ca(ClO)2,易与空气中的水和二氧化碳反应生成不稳定的HClO而变质,应密封保存,故D错误;
故选D.
点评 本题考查氯气、氯水以及漂白粉的组成和性质,题目难度不大,本题注意把握新制氯水的性质,变价金属和强氧化剂反应生成高价金属的盐.

练习册系列答案
相关题目
6.在化学的发展史上,许多科学家创建的理论对化学科学的发展起到重大的作用.有关科学家与其创建的理论对应不匹配的是( )
| A. | 墨子:物质的分割是有条件的 | B. | 汤姆生:葡萄干面包模型 | ||
| C. | 德谟克利特:古典原子论 | D. | 贝克勒尔:原子结构的行星模型 |
7.25℃时某水溶液中c(H+)等于10-10mol/L,该溶液的溶质不可能是( )
| A. | Ba(OH)2 | B. | HCl | C. | NH3•H2O | D. | CH3COONa |
4.两种电解装置:①以铜为电极电解Na2SO4溶液;②以铂为电极电解Na2SO4溶液.当两装置中产生的氢气质量相同时,两装置消耗的水的质量之比为( )
| A. | 1:1 | B. | 1:2 | ||
| C. | 2:1 | D. | 有一装置不消耗水,无法比较 |
1.只用一种试剂可区别Na2SO4、MgCl2、FeCl2、Al2(SO4)3、(NH4)2SO4五种溶液,这种试剂是( )
| A. | NaOH | B. | H2SO4 | C. | BaCl2 | D. | AgNO3 |
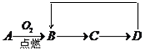 A-D是含同一元素的四种物质,相互之间有如图的转化关系,其中A是单质,D是最高价氧化物的水合物.那么A不可能是( )
A-D是含同一元素的四种物质,相互之间有如图的转化关系,其中A是单质,D是最高价氧化物的水合物.那么A不可能是( )