题目内容
在下列化合物中:H2O2、Na2O2、I2、NaCl、CO2、NH4Cl用化学式回答下列问题:
(1)只由非金属元素组成的离子化合物是 ;
(2)只有极性共价键的共价化合物是 ;
(3)只含有非极性共价键的是 ;
(4)既有离子键又有非极性键的化合物是 .
(1)只由非金属元素组成的离子化合物是
(2)只有极性共价键的共价化合物是
(3)只含有非极性共价键的是
(4)既有离子键又有非极性键的化合物是
考点:离子化合物的结构特征与性质,极性键和非极性键
专题:化学键与晶体结构
分析:一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,含有离子键的化合物是离子化合物,只含共价键的化合物是共价化合物,据此分析解答.
解答:
解:H2O2中H原子和O原子之间存在极性共价键、O原子和O原子之间只存在非极性共价键,为共价化合物;
Na2O2中钠离子和过氧根离子之间存在离子键、O原子和O原子之间存在非极性共价键,为离子化合物;
I2中两个I原子之间只存在非极性共价键,为单质;
NaCl中钠离子和氯离子之间存在离子键,为离子化合物;
CO2中C原子和O原子之间只存在极性共价键,为共价化合物;
NH4Cl中铵根离子和氯离子之间只存在离子键、N原子和H原子之间存在极性共价键,为离子化合物;
(1)(1)只由非金属元素组成的离子化合物是NH4Cl,故答案为:NH4Cl;
(2)只有极性共价键的共价化合物是CO2,故答案为:CO2;
(3)只含有非极性共价键的是I2,故答案为:I2;
(4)既有离子键又有非极性键的化合物是Na2O2,故答案为:Na2O2.
Na2O2中钠离子和过氧根离子之间存在离子键、O原子和O原子之间存在非极性共价键,为离子化合物;
I2中两个I原子之间只存在非极性共价键,为单质;
NaCl中钠离子和氯离子之间存在离子键,为离子化合物;
CO2中C原子和O原子之间只存在极性共价键,为共价化合物;
NH4Cl中铵根离子和氯离子之间只存在离子键、N原子和H原子之间存在极性共价键,为离子化合物;
(1)(1)只由非金属元素组成的离子化合物是NH4Cl,故答案为:NH4Cl;
(2)只有极性共价键的共价化合物是CO2,故答案为:CO2;
(3)只含有非极性共价键的是I2,故答案为:I2;
(4)既有离子键又有非极性键的化合物是Na2O2,故答案为:Na2O2.
点评:本题考查了化学键和物质的关系,明确物质的构成微粒是解本题关键,注意离子键和共价键的区别,注意氯化铵虽然全部是由非金属元素组成的,但为离子化合物.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下面4组物质中,能发生反应且既属于离子反应又属于氧化还原反应的是( )
| A、硫酸钠溶液与氯化钡溶液 |
| B、铝片与硝酸汞溶液 |
| C、稀硫酸与铜片 |
| D、硝酸钠溶液与氯化钾溶液 |
下列关于中性溶液的说法正确的是( )
| A、中性溶液就是PH=7的溶液 |
| B、中性溶液是指c(H+)=c(OH-)的溶液 |
| C、酸与碱恰好完全中和所得的溶液是中性溶液 |
| D、不能使酸碱指示剂显色的溶液是中性溶液 |
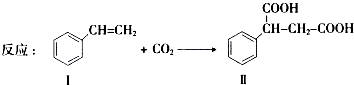
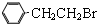 通过消去反应制备Ⅰ的化学方程式为
通过消去反应制备Ⅰ的化学方程式为
 A、B、C、D、E、F、G为原子序数依次递增的7种短周期主族元素.A、B元素的最高正价与最低负价的代数和均为零;C元素是植物生长三大营养元素之一;D的单质具有强氧化性,其氢化物能和一种半导体材料反应生成常温常压下的两种气体;E原子核外K层电子数与M层电子数相等;F原子的价电子数等于电子层数的两倍.请回答下列问题:
A、B、C、D、E、F、G为原子序数依次递增的7种短周期主族元素.A、B元素的最高正价与最低负价的代数和均为零;C元素是植物生长三大营养元素之一;D的单质具有强氧化性,其氢化物能和一种半导体材料反应生成常温常压下的两种气体;E原子核外K层电子数与M层电子数相等;F原子的价电子数等于电子层数的两倍.请回答下列问题: 实验室用乙醇与浓硫酸共热制取乙烯,常因温度过高生成少量SO2,有人设计了如图所示实验,以验证上述混合气体中是否含有乙烯和SO2.
实验室用乙醇与浓硫酸共热制取乙烯,常因温度过高生成少量SO2,有人设计了如图所示实验,以验证上述混合气体中是否含有乙烯和SO2.