题目内容
7.亚硝酸钠常用作食品防腐剂.现用如图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸的反应及生成气体产物的成分.已知:①NO+NO2+2OH-═2NO${\;}_{2}^{-}$+H2O ②气体液化的温度:NO2:21℃、NO:-152℃

(1)为了检验装置A中生成的气体,仪器的连接顺序为(按左→右连接):A→C→E→D→B.
(2)组装好仪器后,接下来进行的操作是检查装置气密性.
(3)关闭弹簧夹K1,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体.
①确认A中产生的气体中含有NO,依据的现象是D中出现红棕色气体.
②装置B的作用是吸收NO2和NO,防止污染空气,装置E的作用是冷凝使NO2完全液化.
(4)如果向D中通入过量O2,则装置B中发生反应的化学方程式为4NO2+O2+4NaOH=4NaNO3+2H2O.如果没有装置C,对实验结论造成的影响是水蒸气存在,会与NO2反应产生NO,影响NO的检验.
分析 硫酸与亚硝酸钠反应生成气体的成分为NO、NO2,其中NO与空气中的氧气被氧化成NO2,所以实验开始前要将装置中的空气排尽,反应前通入氮气的目的是排尽装置内的空气,防止可能产生的NO被氧化成NO2,造成对A中反应产物检验的干扰,根据各部分装置的作用可知,C吸收水蒸气,B尾气处理,防止污染空气,D检验NO,E冷却二氧化氮,利用D检验NO,装置的连接为A→C→E→D→B,
(1)根据各部分装置的作用进行连接,C吸收水蒸气,B尾气处理,防止污染空气,D检验NO,E冷却二氧化氮,利用D检验NO;
(2)气体发生和反应装置需要装置气密性好,开始前需要检查装置气密性;
(3)根据一氧化氮和氧气反应生成红棕色二氧化氮气体判断,温度低于二氧化氮液化温度时,二氧化氮变成液态;
(4)氧气过量,进入B中可理解为先生成硝酸,硝酸再与氢氧化钠反应生成硝酸钠和水.
解答 解:(1)C吸收水蒸气,B尾气处理,防止污染空气,D检验NO,E冷却二氧化氮,利用D检验NO,所以装置的连接为A→C→E→D→B,
故答案为:E;D;
(2)组装好仪器后,接下来进行的操作实验是检查装置气密性,
故答案为:检查装置气密性;
(3)①D中无色气体变成红色,说明含有NO气体,2NO+O2=2NO2,
故答案为:D中出现红棕色气体;
②装置B是吸收氮氧化物,防止污染空气,二氧化氮的液化温度是21℃,低于此温度时,二氧化氮气体变成液态,
故答案为:吸收NO2和NO,防止污染空气;冷凝使NO2完全液化;
(4)如果向D中通入过量O2,则装置B中二氧化氮、氧气和氢氧化钠反应生成硝酸钠和水,其反应方程式为:4NO2+O2+4NaOH=4NaNO3+2H2O,如果没有装置C,二氧化氮和水反应生成一氧化氮,造成干扰,
故答案为:4NO2+O2+4NaOH=4NaNO3+2H2O;水蒸气存在,会与NO2反应产生NO,影响NO的检验.
点评 本题考查了实验方案设计、物质的检验、盖斯定律,明确物质的性质是解本题关键,根据实验现象确定物质的性质,注意仪器的连接顺序,为易错点,题目难度中等.

 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案| A. | H2、D2、T2互为同素异形体 | |
| B. | 液氨、氨水、王水都是混合物 | |
| C. | H2O、苯酚、Fe(SCN)3都是弱电解质 | |
| D. | 硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 |
| A. | 中和滴定达中点时俯视滴定管内液面度数 | |
| B. | 碱式滴定管用蒸馏水洗净后立即装待测溶液来滴定 | |
| C. | 酸式滴定管用蒸馏水洗净后立即装标准溶液来滴定 | |
| D. | 把配好的标准溶液倒入刚用蒸馏水洗净的锥形瓶中然后用来滴定 |
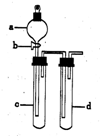 某兴趣小组设计出如图所示装置来进行“铜与硝酸反应”实验,以探究化学实验的绿色化.
某兴趣小组设计出如图所示装置来进行“铜与硝酸反应”实验,以探究化学实验的绿色化.(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c,其目的是检查装置气密性.
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2mL浓硝酸,c中反应的化学方程式是Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O.
再由a向c中加2mL蒸馏水,c中的实验现象是反应变缓,红棕色气体逐渐变为无色.
(3)如表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是丙,理由是制取等量的硝酸铜时,丙方案耗酸量最少、无污染物(NOX)产生.
| 方 案 | 反 应 物 |
| 甲 | Cu、浓HNO3 |
| 乙 | Cu、稀HNO3 |
| 丙 | Cu、O2、稀HNO3 |
| A. | 人们可以把放热反应释放的能量转化为其它可利用的能量,而吸热反应没有利用价值 | |
| B. | 太阳能热水器、沼气的使用、玉米制乙醇都涉及生物质能的利用 | |
| C. | 地球上最基本的能源是化学能 | |
| D. | 利用二氧化碳制造全降解塑料能有效减少“白色污染” |
| A. | 3.5 pmol | B. | (3m+$\frac{n}{2}$-3p)mol | C. | (3m+$\frac{n}{2}$)mol | D. | (3m+n)mol |

| A. | 图1表示0.1000mol•L-1NaOH溶液滴定20.00ml 0.1000 mol•L-1醋酸溶液得到滴定曲线 | |
| B. | 图2所示在H2S溶液导电性实验中,曲线可确定通入的气体X为Cl2 | |
| C. | 图3在其它条件不变时,2SO2(g)+O2(g)?2SO3(g)转化关系中,纵坐标表示O2的转化率 | |
| D. | 由图4所示曲线可知,酶催化比化学催化的效果好 |
 50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在下图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.
50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在下图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热. ②HClO的结构式H-O-Cl
②HClO的结构式H-O-Cl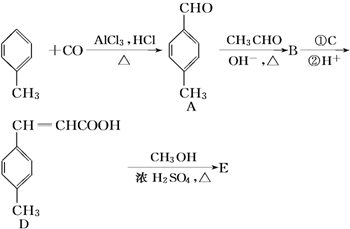
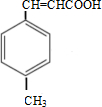 +CH3OH$→_{△}^{浓硫酸}$
+CH3OH$→_{△}^{浓硫酸}$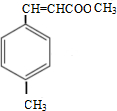 +H2O
+H2O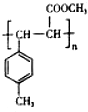 .
.