题目内容
2.2011年,瑞士洛桑联邦工学院无理学家发现后用一种辉钼(MoS2)单分子层材料制造半导体,比传统硅材料和富勒烯更有优势.工业上用辉钼矿冶炼钼的化学原理:①2MoS2+7O2$\stackrel{高温}{→}$2MoO3+4SO2 ②MoO3+2NH3•H2O═(NH4)2MoO4+H2O
③(NH4)2MoO4+2HCl═H2MoO4↓+2NH4Cl ④H2MoO4═MoO3+H2O
⑤用还原剂将MoO3还原成金属钼,下列说法正确的是( )
| A. | MoS2煅烧产生的尾气可直接排到空气中 | |
| B. | MoO3不溶于氢氧化钠溶液 | |
| C. | H2MoO4是一种强酸 | |
| D. | 利用H2、CO和Al分别还原等量的MoO3,消耗还原剂的物质的量之比为3:3:2 |
分析 A.MoS2煅烧生成SO2,为污染性气体;
B.与酸反应生成盐和水的氧化物为碱性氧化物,而该氧化物与碱反应生成盐和水;
C.由反应④中,不溶性弱酸分解生成氧化物和水;
D.还原等量的MoO3,转移电子数相同,以此计算.
解答 解:A.从反应①看,MoS2煅烧后的产物中有SO2,它是大气污染物,因此尾气不能直接排入空气中,故A错误;
B.由反应②可知,MoO3属于酸性氧化物,溶于氢氧化钠,故B错误;
C.由反应④可知,H2MoO4是一种弱酸,故C错误;
D.还原等量的MoO3,转移电子数相同,若转移6mol电子,需要还原剂物质的量之比为3:3:2,故D正确;
故选D.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,注意利用信息分析问题,题目难度不大.

练习册系列答案
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
17.19世纪门捷列夫的突出贡献是( )
| A. | 发现了元素周期律 | B. | 提出了原子学说 | ||
| C. | 发现了稀有气体 | D. | 提出了分子学说 |
7.一定质量的下列各组物质的混合物,不管两者以何种质量比混合,充分燃烧后所生成的H2O的质量都相等,该混合物可能是( )
| A. | 乙醇(C2H5OH)和乙烯 | B. | 丙烷和乙醛(CH3CHO) | ||
| C. | 乙烯和乙酸乙酯(CH3COOC2H5) | D. | 甲醛(HCHO)和葡萄糖(C6H12O6) |
11.要鉴别己烯中是否混有少量甲苯,正确的实验方法是( )
| A. | 先加足量的KMnO4酸性溶液,然后再加入溴水 | |
| B. | 先加足量溴水,然后再加入KMnO4酸性溶液 | |
| C. | 点燃这种液体,然后再观察火焰的颜色 | |
| D. | 加入浓硫酸与浓硝酸后加热 |
12.有一固体混合物,可能含有阴离子:NO${\;}_{3}^{-}$、SO42-、SO32-、CO32-、AlO${\;}_{2}^{-}$,阳离子:K+、Al3+、Cu2+、NH${\;}_{4}^{+}$、Na+.为了鉴定其中的离子,现进行如下实验,实验现象和结论相符的是( )
| A. | 向溶液中加入盐酸酸化的BaCl2溶液,有白色沉淀生成,说明一定含有SO${\;}_{4}^{2-}$ | |
| B. | 向溶液中滴加盐酸溶液,开始有沉淀生成,继续滴加,沉淀消失,同时有气体逸出,说明一定存在CO32-和AlO${\;}_{2}^{-}$ | |
| C. | 用焰色反应检验时,透过蓝色钴玻璃观察火焰呈紫色,则说明含有K+没有Na+ | |
| D. | 取该粉末,加水后得到无色溶液,且未嗅到气味;用pH试纸测得溶液的pH为12,说明不存在NH${\;}_{4}^{+}$、Al3+、Cu2+ |

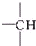 和
和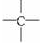 等结构组成的.如果某烷烃分子中同时存在这4种基团,所含碳原子数又最少,这种烃分子应含8个碳原子.
等结构组成的.如果某烷烃分子中同时存在这4种基团,所含碳原子数又最少,这种烃分子应含8个碳原子.


