题目内容
7.下列说法正确的是( )| A. | 石油的分馏和煤的液化都是发生了物理变化 | |
| B. | 乙烯和乙炔都能与溴水发生加成反应且生成的产物相同 | |
| C. | 甲烷和氯气反应生成一氯甲烷与苯和硝酸反应生成硝基苯的反应类型相同 | |
| D. | 苯能使酸性高锰酸钾溶液褪色,也能使溴的四氯化碳溶液褪色 |
分析 A.煤的液化为化学变化;
B.乙烯和乙炔含有的官能团不同;
C.甲烷与氯气反应,以及苯与硝酸反应,都是H原子被替代;
D.苯与高锰酸钾不反应.
解答 解:A.煤的液化生成甲醇等,为化学变化,故A错误;
B.乙烯和乙炔含有的官能团不同,与溴水发生加成反应生成物不同,故B错误;
C.甲烷与氯气反应,以及苯与硝酸反应,都是H原子被替代,都为取代反应,故C正确;
D.苯性质稳定,与高锰酸钾不反应,故D错误.
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重常见有机物性质及分析与应用能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
| A. | 电解饱和食盐水时阳极的电极反应式为:2Cl--2e-═Cl2↑ | |
| B. | 氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- | |
| C. | 粗铜精炼时,与电源正极相连的是铜 | |
| D. | 钢铁发生电化学腐蚀的正极反应式:Fe-2e-═Fe2+ |
15.下列仪器名称为“镊子”的是( )
| A. |  | B. |  | C. |  | D. |  |
2.下列不属于化石能源的是( )
| A. | 天然气 | B. | 生物质能 | C. | 煤 | D. | 石油 |
12. 己知反应:2Al(l) $\stackrel{催化剂}{?}$B(l)△H=-QkJ/mol,取等量A分别在0℃和20℃下反应,测得其转化率Y随时间t变化的关系曲线(Y-t)如图所示.下列说法正确的是( )
己知反应:2Al(l) $\stackrel{催化剂}{?}$B(l)△H=-QkJ/mol,取等量A分别在0℃和20℃下反应,测得其转化率Y随时间t变化的关系曲线(Y-t)如图所示.下列说法正确的是( )
 己知反应:2Al(l) $\stackrel{催化剂}{?}$B(l)△H=-QkJ/mol,取等量A分别在0℃和20℃下反应,测得其转化率Y随时间t变化的关系曲线(Y-t)如图所示.下列说法正确的是( )
己知反应:2Al(l) $\stackrel{催化剂}{?}$B(l)△H=-QkJ/mol,取等量A分别在0℃和20℃下反应,测得其转化率Y随时间t变化的关系曲线(Y-t)如图所示.下列说法正确的是( )| A. | a代表20℃下A的Y-t曲线 | |
| B. | 反应到66min时,0℃和20℃下反应放出的热量相等 | |
| C. | 0℃和20℃下达到平衡时,反应都放出QkJ热量 | |
| D. | 反应都达到平衡后,正反应速率a>b |
6.能证明某溶液中含有氯化钠的是( )
| A. | 焰色反应是黄色 | |
| B. | 溶液有咸味 | |
| C. | 取少量溶液于试管中,滴加稀硝酸酸化的硝酸银溶液,出现白色沉淀 | |
| D. | 既出现A中的现象,又出现C中的现象 |
4.下列化学反应中,属于氧化还原反应的是( )
| A. | Na2CO3+CaCl2═CaCO3↓+2NaCl | B. | Fe+CuSO4═Cu+FeSO4 | ||
| C. | 2NaHCO3═Na2CO3+CO2↑+H2O | D. | CaO+H2O═Ca(OH)2 |
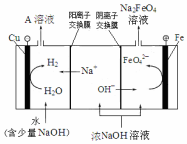 高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂.
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂.