题目内容
13.下列水溶液中的各组离子能大量共存的是( )| A. | Na+、Ba2+、Cl?、SO42- | B. | Ca2+、HCO3?、C1?、K+ | ||
| C. | HCO3?、K+、I?、H+ | D. | H+、Cl?、Na+、CO32 |
分析 A.钡离子与硫酸根离子反应生成硫酸钡沉淀;
B.四种离子之间不反应,能够共存;
C.碳酸氢根离子与氢离子反应;
D.氢离子与碳酸根离子反应.
解答 解:A.Ba2+、SO42-之间反应生成难溶物硫酸钡,在溶液中不能大量共存,故A错误;
B.Ca2+、HCO3-?、Cl-?、K+之间不发生反应,在溶液中能够大量共存,故B正确;
C.HCO3-、H+之间反应生成二氧化碳气体,在溶液中不能大量共存,故C错误;
D.H+、CO32-之间发生反应,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的正误判断,为中等难度的试题,注意熟练掌握离子反应发生条件,明确离子不能大量共存的一般情况:能发生复分解反应的离子之间; 能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
3. 已知某可逆反应:2M(g)?N(g)△H<0.现将M和N的混和气体通入容积为l L的恒温密闭容器中,反应体系中各物质浓度随时间变化关系如图所示.下列说法中,正确的是( )
已知某可逆反应:2M(g)?N(g)△H<0.现将M和N的混和气体通入容积为l L的恒温密闭容器中,反应体系中各物质浓度随时间变化关系如图所示.下列说法中,正确的是( )
 已知某可逆反应:2M(g)?N(g)△H<0.现将M和N的混和气体通入容积为l L的恒温密闭容器中,反应体系中各物质浓度随时间变化关系如图所示.下列说法中,正确的是( )
已知某可逆反应:2M(g)?N(g)△H<0.现将M和N的混和气体通入容积为l L的恒温密闭容器中,反应体系中各物质浓度随时间变化关系如图所示.下列说法中,正确的是( )| A. | a、b、c、d四个点中处于平衡状态的点是a、b | |
| B. | 反应进行至25 min时,曲线发生变化的原因是加入了0.4 mol N | |
| C. | 若调节温度使35 min时体系内N的体积分数与15 min时相等,应升高温度 | |
| D. | 若在40 min时出现如图所示变化,则可能是因为加入催化剂引起的 |
1.下列物质暴露在空气中不易变质的是( )
| A. | 氯化钠 | B. | 氢氧化钠 | C. | 溴化银 | D. | 漂白粉 |
8.同温同压下,已知下列各反应为放热反应,下列各热化学方程式中热量数值最小的是( )
| A. | 2A ( l )+B ( l )=2C (g )△H1 | B. | 2A ( g )+B ( g )=2C (g )△H2 | ||
| C. | 2A ( g )+B ( g )=2C ( l )△H3 | D. | 2A ( l )+B ( l )=2C ( l )△H4 |
5.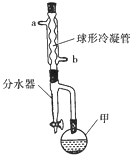 乙酸异戊酯常作为配制香蕉、梨、苹果等多种口味食品的香料.实验室合成乙酸异戊酯的原料是乙酸和异戊醇[(CH3)2CHCH2CH2OH],其装置如图所示.
乙酸异戊酯常作为配制香蕉、梨、苹果等多种口味食品的香料.实验室合成乙酸异戊酯的原料是乙酸和异戊醇[(CH3)2CHCH2CH2OH],其装置如图所示.
合成反应:
在甲中加入20g异戊醇和少量碎瓷片,在不断搅拌下加入2mL浓硫酸,冷却后加入100g稍过量的冰醋酸,再加入环己烷(能与产物形成共沸混合物,不参加反应).安装带有分水器(预装有一定量的水)的冷凝回流装置,球形冷凝管中通入冷却水,用甘油浴缓慢加热仪器甲,冷凝回流一段时间.
分离提纯:
将反应粗产品倒入分液漏斗中,分别用少量10% Na2CO3溶液分两次洗涤.分去水层,向有机层中加入无水硫酸镁固体,静置一段时间后分离出液体,最后蒸馏除去环己烷得到纯净的乙酸异戊酯13g.
已知下列物质的沸点和密度:
请回答下列问题:
(1)合成乙酸异戊酯的化学方程式为CH3COOH+(CH3)2CHCH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH(CH3)2+H2O.
(2)仪器甲的名称是圆底烧瓶.
(3)分水器可将仪器甲中产生的水分离出来,目的是提高反应物的转化率或生成物的产率;按照球形冷凝管中冷却水的流向应该由b(填“a”或“b”)口进水.
(4)本实验使用甘油浴加热的优点有便于控制反应温度、使圆底烧瓶受热均匀 (答出两点即可).
(5)当观察到分水器中出现水层高度(或水的体积、液面对应刻度)不再变化现象时,可停止加热仪器甲,终止合成反应过程.
(6)用10%Na2CO3溶液洗涤的作用是ad.
a、除去未反应完的醋酸 b、提高异戊醇的转化率
c、与异戊醇反应,除去杂质 d、降低乙酸异戊酯在水中的溶解能力
(7)本实验中无水硫酸镁的作用是作干燥剂.
(8)本实验中异戊醇的转化率为44%.
 乙酸异戊酯常作为配制香蕉、梨、苹果等多种口味食品的香料.实验室合成乙酸异戊酯的原料是乙酸和异戊醇[(CH3)2CHCH2CH2OH],其装置如图所示.
乙酸异戊酯常作为配制香蕉、梨、苹果等多种口味食品的香料.实验室合成乙酸异戊酯的原料是乙酸和异戊醇[(CH3)2CHCH2CH2OH],其装置如图所示.合成反应:
在甲中加入20g异戊醇和少量碎瓷片,在不断搅拌下加入2mL浓硫酸,冷却后加入100g稍过量的冰醋酸,再加入环己烷(能与产物形成共沸混合物,不参加反应).安装带有分水器(预装有一定量的水)的冷凝回流装置,球形冷凝管中通入冷却水,用甘油浴缓慢加热仪器甲,冷凝回流一段时间.
分离提纯:
将反应粗产品倒入分液漏斗中,分别用少量10% Na2CO3溶液分两次洗涤.分去水层,向有机层中加入无水硫酸镁固体,静置一段时间后分离出液体,最后蒸馏除去环己烷得到纯净的乙酸异戊酯13g.
已知下列物质的沸点和密度:
| 甘油 | 环已烷 | 乙酸 | 异戊醇 | |
| 沸点/℃ | 290 | 80.7 | 117.9 | 132.5 |
| 密度/g•cm-3 | 1.26 | 0.78 | 1.05 | 0.81 |
(1)合成乙酸异戊酯的化学方程式为CH3COOH+(CH3)2CHCH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH(CH3)2+H2O.
(2)仪器甲的名称是圆底烧瓶.
(3)分水器可将仪器甲中产生的水分离出来,目的是提高反应物的转化率或生成物的产率;按照球形冷凝管中冷却水的流向应该由b(填“a”或“b”)口进水.
(4)本实验使用甘油浴加热的优点有便于控制反应温度、使圆底烧瓶受热均匀 (答出两点即可).
(5)当观察到分水器中出现水层高度(或水的体积、液面对应刻度)不再变化现象时,可停止加热仪器甲,终止合成反应过程.
(6)用10%Na2CO3溶液洗涤的作用是ad.
a、除去未反应完的醋酸 b、提高异戊醇的转化率
c、与异戊醇反应,除去杂质 d、降低乙酸异戊酯在水中的溶解能力
(7)本实验中无水硫酸镁的作用是作干燥剂.
(8)本实验中异戊醇的转化率为44%.