题目内容
短周期元素X,Y,Z,W在元素周期表中的相对位置如图所示.其中Y所处的周期序数与族序数相等.下列说法正确的是( )
| X | |||
| Y | Z | W |
| A、原子半径:X>Z>Y |
| B、Z的最高价氧化物能与NaOH,HF反应,但不是两性氧化物 |
| C、最高价氧化物对应水化物的酸性:Z>W |
| D、X与O元素和H元素形成的化合物一定是共价化合物 |
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:短周期元素X、Y、Z、W,根据元素在周期表中的位置知,X位于第二周期,Y、Z、W位于第三周期;
Y所处的周期序数与族序数相等,则Y位于第三周期第IIIA族,所以Y为Al元素、Z为Si元素、X为N元素、W为S元素,然后结合元素周期表、元素周期律的知识对各选项判断.
Y所处的周期序数与族序数相等,则Y位于第三周期第IIIA族,所以Y为Al元素、Z为Si元素、X为N元素、W为S元素,然后结合元素周期表、元素周期律的知识对各选项判断.
解答:
解:短周期元素X、Y、Z、W,根据元素在周期表中的位置知,X位于第二周期,Y、Z、W位于第三周期,Y所处的周期序数与族序数相等,则Y位于第三周期第IIIA族,所以Y为Al元素、Z为Si元素、X为N元素、W为S元素,
A.同一周期中,元素的原子半径随着原子序数的增大而减小;电子层越多,原子半径越大,所以原子半径大小顺序为:Y>Z>X,故A错误;
B.Z为Si元素,其最高价氧化物为二氧化硅,二氧化硅不能与硅酸以外其它酸反应,所以二氧化硅不属于酸性氧化物,故B正确;
C.同一周期中,元素的非金属性随着原子序数的增大而增强,元素的非金属性越强,其最高价氧化物的水化物酸性越强,Z的非金属性小于W,所以W的最高价氧化物的水化物酸性大于Z,故C错误;
D.X为N元素,N、H、O元素可以形成硝酸铵,硝酸铵为离子化合物,故D错误;
故选B.
A.同一周期中,元素的原子半径随着原子序数的增大而减小;电子层越多,原子半径越大,所以原子半径大小顺序为:Y>Z>X,故A错误;
B.Z为Si元素,其最高价氧化物为二氧化硅,二氧化硅不能与硅酸以外其它酸反应,所以二氧化硅不属于酸性氧化物,故B正确;
C.同一周期中,元素的非金属性随着原子序数的增大而增强,元素的非金属性越强,其最高价氧化物的水化物酸性越强,Z的非金属性小于W,所以W的最高价氧化物的水化物酸性大于Z,故C错误;
D.X为N元素,N、H、O元素可以形成硝酸铵,硝酸铵为离子化合物,故D错误;
故选B.
点评:本题考查了元素位置、结构和性质的关系及应用,根据元素在周期表中的位置推断元素,明确元素周期律是解本题关键,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案
相关题目
下列的分离方法不正确的是( )
| A、用过滤的方法除去食盐水中的泥沙 |
| B、用蒸馏的方法将自来水制成蒸馏水 |
| C、用酒精萃取碘水中的碘 |
| D、用加热的方法除去苏打中的小苏打 |
设NA代表阿伏加德罗常数,下列叙述正确的是( )
| A、标准状况下,将5.6L的O2和5.6LNO的混合后的分子数约为0.5NA |
| B、2L 0.5mol/L BaCl2溶液中,阳离子所带电荷数为 NA |
| C、常温常压下,将0.2mol铝片投入含0.6molH2SO4的浓硫酸中,生成0.3 NA个SO2分子 |
| D、42g丙烯气体中,含有的σ键数目为8NA |
下列图示与对应的叙述不相符的是( )
A、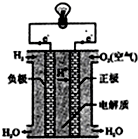 如图表示氢氧燃料电池构造示意图 |
B、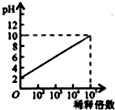 如图表示室温下pH=2的HCl溶液加水稀释倍数与pH的变化关系 |
C、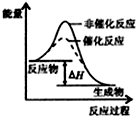 如图表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
D、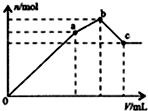 如图表示向NH4 Al(S04)2溶液中逐滴滴人Ba(OH)2溶液,生成沉淀总物质的量(n)随 着Ba(OH)2溶液体积(y)的变化 |
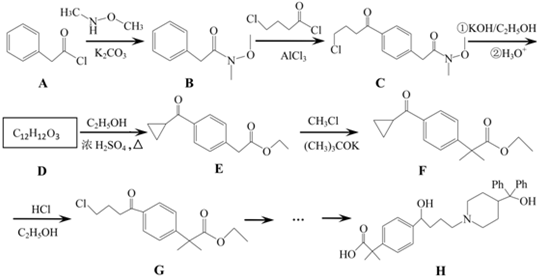
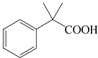 是一种重要的有机合成中间体,请完成以苯乙烯为主要原料(其他试剂自选)合成该化合物的合成路线流程图.合成路线流程图示例如下:H2C=CH2
是一种重要的有机合成中间体,请完成以苯乙烯为主要原料(其他试剂自选)合成该化合物的合成路线流程图.合成路线流程图示例如下:H2C=CH2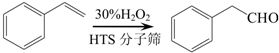 →
→