题目内容
7.室温下,下列电解质溶液叙述正确的是( )| A. | pH=11的Na2SO3溶液中,水电离的c(H+)=1.0×10-11mol/L | |
| B. | 将0.2mol•L-1盐酸与0.1mol•L-1的KAlO2溶液等体积混合,溶液中离子浓度由小到大的顺序:c(OH-)<c(Al3+)<c(H+)<c(K+)<c(Cl-) | |
| C. | 浓度相同的①NH4Cl②(NH4)2SO4③(NH4)2CO3④NH4HSO4四种溶液,c(NH4+)大小顺序为:②>③>④>① | |
| D. | pH=4的NaHC2O4溶液中存在:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+c(C2O42-) |
分析 A.含有弱离子的盐促进水电离,水电离出c(H+)=c(OH-);
B.假设两种溶液体积都是1L,则n(HCl)=0.2mol/L×1L=0.2mol,n(KAlO2)=0.1mol/L×1L=0.1mol,发生的反应为HCl+H2O+KAlO2=KCl+Al(OH)3↓、Al(OH)3+3HCl=AlCl3+3H2O,根据方程式知,生成0.1mol氢氧化铝,剩余0.1molHCl会溶解$\frac{0.1}{3}$molAl(OH)3,所以溶液中溶质为$\frac{0.1}{3}$molAlCl3、0.1molKCl,氯化铝是强酸弱碱盐,其水溶液呈酸性,再结合物料守恒判断;
C.氢离子抑制铵根离子水解,碳酸根离子促进铵根离子水解,铵根离子水解程度较小,结合铵根离子系数判断;
D.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断.
解答 解:A.含有弱离子的盐促进水电离,水电离出c(H+)=c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-11}}$mol/L=1.0×10-3mol/L,故A错误;
B.假设两种溶液体积都是1L,则n(HCl)=0.2mol/L×1L=0.2mol,n(KAlO2)=0.1mol/L×1L=0.1mol,发生的反应为HCl+H2O+KAlO2=KCl+Al(OH)3↓、Al(OH)3+3HCl=AlCl3+3H2O,根据方程式知,生成0.1mol氢氧化铝,剩余0.1molHCl会溶解$\frac{0.1}{3}$molAl(OH)3,所以溶液中溶质为$\frac{0.1}{3}$molAlCl3、0.1molKCl,氯化铝是强酸弱碱盐,其水溶液呈酸性,再结合物料守恒得c(OH-)<c(H+)<c(Al3+)<c(K+)<c(Cl-),故B错误;
C.氢离子抑制铵根离子水解,碳酸根离子促进铵根离子水解,铵根离子水解程度较小,结合铵根离子系数得c(NH4+)大小顺序为:②>③>④>①,故C正确;
D.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-),故D错误;
故选C.
点评 本题考查离子浓度大小比较,涉及盐类水解、物质之间的反应等知识点,为高频考点,注意电荷守恒和物料守恒的应用,易错选项是B,注意二者混合后溶液中的溶质成分及其物质的量,题目难度中等.

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案| A. | 漂白粉是混合物,有效成分是CaCl2 | |
| B. | 光照氯水有气泡逸出,该气体是Cl2 | |
| C. | Cl2能使湿润的有色布条褪色,说明Cl2具有漂白性 | |
| D. | 实验室用二氧化锰与浓盐酸反应制取Cl2 |
| A. | 阴极:2H++2e-═H2↑阳极:4OH--4e-═2H2O+O2↑ | |
| B. | 阴极:2H++2e-═H2↑阳极:2Cl--2e-═Cl2↑ | |
| C. | 阴极:Cu2++2e-═Cu阳极:4OH--4e-═2H2O+O2↑ | |
| D. | 阴极:Cu2++2e-═Cu阳极:2Cl--=2e-═Cl2↑ |
| A. | 元素B的单质与化合物A2D反应能生成D的单质 | |
| B. | 工业上利用铝热反应可制得单质C | |
| C. | 原子B、C、D半径的大小顺序:D>C>B | |
| D. | 一定条件下,过量的B单质与D单质直接生成BD3 |
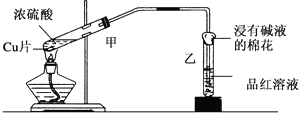
| A. | 甲试管内溶液变为蓝色 | |
| B. | 乙试管中品红溶液红色褪去 | |
| C. | 棉花上喷入的溶液可能为氢氧化钠溶液 | |
| D. | 棉花上喷入的溶液可能为饱和碳酸钠溶液 |
| A. | 2W-+Z2═W2+2Z- | B. | 2Y-+W2═Y2+2W- | C. | 2Z-+X2═Z2+2X- | D. | 2X-+Y2═X2+2Y- |


