题目内容
8.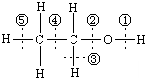 图为乙醇分子的化学键示意图,请按要求回答问题:
图为乙醇分子的化学键示意图,请按要求回答问题:(1)乙醇发生消去反应,断②⑤处的化学键;
(2)乙醇在某反应中仅断裂①处的化学键,请写出2个对应的化学方程式(反应类型不同):2CH3CH2OH+2Na→2CH3CH2ONa+H2↑、CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.
分析 (1)乙醇发生消去反应时,②⑤键断裂生成乙烯;如果①③键断裂则生成乙醛;
(2)乙醇在某反应中仅断裂①处的化学键,则乙醇和Na或羧酸反应.
解答 解:(1)乙醇发生消去反应时,②⑤键断裂生成乙烯;如果①③键断裂则生成乙醛,
故答案为:②⑤;
(2)乙醇在某反应中仅断裂①处的化学键,则乙醇和Na或羧酸反应,反应方程式分别为2CH3CH2OH+2Na→2CH3CH2ONa+H2↑、CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,
故答案为:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑; CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.
点评 本题以乙醇为载体考查方程式的书写及物质结构,明确官能团及其性质关系是解本题关键,会根据断键方式确定反应类型,题目难度不大.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
18.一定质量的某有机物与足量的钠反应生成V1L气体.等量的该有机物与过量的NaHCO3反应,生成相同状况下的气体V2L.若V1>V2.该有机物可能是下列中的( )
| A. | HOOC-COOH | B. | HO(CH2)2COOH | C. | CH2OHCHOHCOOH | D. | (CH3)3CCOOH |
19.一次区分乙酸、乙醇、苯、四氯化碳四种液体的试剂是( )
| A. | H2O | B. | 溴水 | ||
| C. | 新制Cu(OH)2 | D. | 酸性高锰酸钾溶液 |
16.某有机物的结构简式: ,该有机物不能发生的反应为( )
,该有机物不能发生的反应为( )
 ,该有机物不能发生的反应为( )
,该有机物不能发生的反应为( )| A. | 加成反应 | B. | 消去反应 | C. | 水解反应 | D. | 聚合反应 |
3.标准状况下,11.2L的下列混合气体完全燃烧后,测得水的质量为22.5g,二氧化碳的质量为44g.该混合气体是( )
| A. | 甲烷和乙烷 | B. | 乙烯和乙烷 | C. | 乙烷和丙烯 | D. | 甲烷和丙烷 |
13.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O$?_{放电}^{充电}$3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述错误的是( )
| A. | 放电时负极反应为:Zn-2e-+2OH-═Zn(OH)2 | |
| B. | 放电时每转移3 mol 电子,正极有1 mol K2FeO4被氧化 | |
| C. | 充电时阳极反应为:Fe(OH)3-3e-+5OH-═FeO${\;}_{4}^{2-}$+4H2O | |
| D. | 充电时阴极附近溶液的碱性增强 |
20.下列做法不会影响食品安全的是( )
| A. | 做菜时用适量的食盐、味精和醋调味 | |
| B. | 把三聚氰胺添加到牛奶中 | |
| C. | 把发霉的大米淘净后做饭 | |
| D. | 把色彩鲜艳的着色剂添加到婴儿食品中 |
19.下列反应中,硝酸只表现氧化性的是( )
| A. | Zn+HNO3(稀)→ | B. | Mg(OH)2+HNO3(稀)→ | C. | C+HNO3(浓)→ | D. | Cu+HNO3(浓)→ |