题目内容
3.标准状况下,11.2L的下列混合气体完全燃烧后,测得水的质量为22.5g,二氧化碳的质量为44g.该混合气体是( )| A. | 甲烷和乙烷 | B. | 乙烯和乙烷 | C. | 乙烷和丙烯 | D. | 甲烷和丙烷 |
分析 根据n=$\frac{V}{{V}_{m}}$计算出混合气体的物质的量,再根据n=$\frac{m}{M}$计算出生成的水和二氧化碳的物质的量,从而得出该混合气体的平均C、H原子数;选项中都是烃,根据平均分子式对各选项进行判断即可.
解答 解:标况下11.2L气体的物质的量为:$\frac{11.2L}{22.4L/mol}$=0.5mol,
22.5g水的物质的量为:$\frac{22.5g}{18g/mol}$=1.25mol,
44g二氧化碳的物质的量为:$\frac{44g}{44g/mol}$=1mol,
则混合气体中平均C、H原子数为:N(C)=$\frac{1mol}{0.5mol}$=2、N(H)=$\frac{1.25mol×2}{0.5mol}$=5,
选项中都是听,则该混合烃的平均分子式为:C2H5,
A.甲烷和乙烷的混合气体的平均C原子数小于2,故A错误;
B.乙烯和乙烷分子中都含有2个C,乙烯分子中含有4个H,乙烷分子中含有6个H,乙烷和乙烯的混合气体的平均分子式可以为C2H5,故B正确;
C.乙烷和丙烯的平均碳原子一定大于2,故C错误;
D.甲烷和丙烷按照1:1混合时平均碳原子数为2,而此时平均H原子数为:$\frac{4+8}{2}$=6,不符合条件,故D错误;
故选B.
点评 本题考查了混合物反应的计算,题目难度中等,明确平均分子式的计算及应用方法为解答关键,注意掌握质量守恒定律在确定有机物分子式中的应用,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
13.研制和开发不含碳并可工业生产的清洁能源,一直是科学家不懈追求的目标.目前液氨被人们视为一种潜在的清洁燃料.液氨燃烧的化学反应方程式为:4NH3+3O2$\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O.和氢燃料相比有关数据见下表,据此判断正确的是( )
①以氨和氢为燃料时,均可以减缓温室效应
②氨泄漏到空气中比氢气更易发生爆炸
③等质量的氨和氢分别燃烧,氨放出的热量多
④氨的液化比氢容易得多.
| 燃料 | 沸点/℃ | 燃烧热/(kJ•mol-1) | 相对分子质量/(g•mol-1) | 液态密度/(g•cm-3) |
| 氢 | -252.60 | 238.40 | 2.02 | 0.07 |
| 氨 | -33.50 | 317.10 | 17.03 | 0.61 |
②氨泄漏到空气中比氢气更易发生爆炸
③等质量的氨和氢分别燃烧,氨放出的热量多
④氨的液化比氢容易得多.
| A. | ①③ | B. | ②③ | C. | ①④ | D. | ②④ |
14.下列各有机物在一定的条件下能发生消去反应的是( )
| A. | CH3Cl | B. | (CH3)3CCH2OH | C. | (CH3)3CCl | D. | 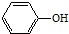 |
18.下列物质①甲烷、②苯、③聚乙烯、④2-丁炔、⑤环己烷、⑥乙烯、⑦苯酚、⑧甲苯,既能使酸性高锰酸钾溶液褪色,又能与溴水反应而使之褪色的是( )
| A. | ③④⑥ | B. | ④⑥⑦ | C. | ④⑤⑧ | D. | ③⑥⑦ |
12.合理饮食是保证我们身体健康的前提,下列关于饮食的说法不正确的是( )
| A. | 水果、蔬菜含有丰富的维生素,若要减肥,每天只吃水果、蔬菜即可 | |
| B. | 米饭含有大量的淀粉,成人每天食用量不能超过500g | |
| C. | 要促进身体健康,饮食必须合理搭配 | |
| D. | 鸡蛋含有丰富的蛋白质,人体所需的蛋白质可由鸡蛋提供,青少年可适当多吃 |
14.下列说法中不正确的是( )
| A. | 碳原子与碳原子之间形成的σ键比π键重叠程度大,形成的共价键强 | |
| B. | 两个原子之间形成共价键时,最多有一个σ键 | |
| C. | 乙炔分子中,共含有4个σ键,1个π键 | |
| D. | 共价单键都属于σ键,π键只存在于双键或叁键中 |
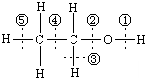 图为乙醇分子的化学键示意图,请按要求回答问题:
图为乙醇分子的化学键示意图,请按要求回答问题: