题目内容
9.酸性锌锰干电池和碱性锌锰干电池的构造简图如下所示,比较二者的异同,回答下列问题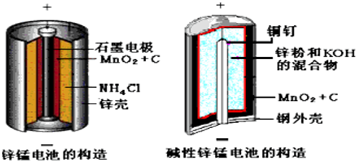
(1)酸性锌锰干电池的负极反应为Zn-2e-=Zn2+.
(2)碱性锌锰干电池在放电过程产生MnOOH,写出正极反应式MnO2+e-+H2O=MnOOH+OH-.
(3)维持电流强度为0.6A,电池工作10分钟,理论消耗Zn0.12g.(结果保留到小数点后两位,F=96500C/mol)
分析 (1)酸性锌锰干电池的负极为锌;
(2)正极上二氧化锰得电子发生还原反应生成MnOOH;
(3)持电流强度为0.6A,电池工作10分钟,则电量为0.6A×600s=360C,转移电子的物质的量为$\frac{360C}{96500C/mol}$=0.00373mol,以此计算消耗锌的质量.
解答 解:(1)酸性锌锰干电池的负极为锌,负极反应为Zn-2e-=Zn2+,
故答案为:Zn-2e-=Zn2+;
(2)在碱性锌锰原电池中,Zn易失电子作负极、二氧化锰作正极,正极上二氧化锰得电子发生还原反应,电极反应式为MnO2+e-+H2O=MnOOH+OH-,
故答案为:MnO2+e-+H2O=MnOOH+OH-;
(3)持电流强度为0.6A,电池工作10分钟,则电量为0.6A×600s=360C,转移电子的物质的量为$\frac{360C}{96500C/mol}$=0.00373mol则消耗Zn的质量为0.00373mol×$\frac{1}{2}$×65g/mol=0.12g,
故答案为:0.12.
点评 本题考查普通干电池的工作原理,有利于培养学生良好的科学素养,题目难度中等.

练习册系列答案
相关题目
19.硼有两种天然同位素${\;}_5^{10}B$、${\;}_5^{11}B$,硼元素的相对原子质量为10.80,硼元素中的${\;}_5^{10}B$质量百分比含量的判断正确的是( )
| A. | 略小于20% | B. | 略大于20% | C. | 20% | D. | 80% |
17.下列物质沉淀时的颜色正确的是( )
| A. | Fe(OH)2--红棕色 | B. | BaSO4--灰绿色 | C. | Al(OH)3--白色 | D. | AgCl--蓝色 |
4.镀锌铁在发生吸氧腐蚀时,若有0.2mol电子发生转移,下列说法正确的是( )
①有5.6g金属被腐蚀
②有6.5g金属被腐蚀
③在标准状况下有2.24L气体吸收
④在标准状况下有1.12L气体吸收.
①有5.6g金属被腐蚀
②有6.5g金属被腐蚀
③在标准状况下有2.24L气体吸收
④在标准状况下有1.12L气体吸收.
| A. | ①② | B. | ②③ | C. | ①④ | D. | ②④ |
14.两种气态烃组成的混合气体0.1mol,完全燃烧得0.16mol CO2和3.6g H2O,下列说法正确的是( )
| A. | 一定有乙烷 | B. | 一定是甲烷和乙烯 | ||
| C. | 一定有甲烷 | D. | 一定有乙炔 |
1.有机物 的正确命名为( )
的正确命名为( )
 的正确命名为( )
的正确命名为( )| A. | 2,3,3-三甲基戊烷 | B. | 3,3,4-三甲基已烷 | ||
| C. | 3,3-二甲基-4-乙基戊烷 | D. | 2-乙基-3,3-二甲基-4-乙基戊烷 |
5.东晋医药学家葛洪的《肘后备急方•治寒热诸疟方》记载有“青蒿一握,以水二升渍,绞取汁,尽服之”用沸点只有35℃的乙醚作为溶剂来提取青蒿素的方法化学上叫萃取的说法,说明不能加热青蒿,因高温可能使活性成分受损.中国药学家屠呦呦用沸点只有35℃的乙醚作为溶剂来提取青蒿素,创制出新型抗疟药青蒿素和双氢青蒿素,为此获得2015年诺贝尔生理学或医学奖.已知青蒿素的结构如图所示,下列有关青蒿素的说法,不正确的是( )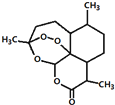

| A. | 用沸点只有35℃的乙醚作为溶剂来提取青蒿素的方法化学上叫萃取 | |
| B. | 能够发生水解反应 | |
| C. | 分子式为C15H23O5 | |
| D. | 青蒿素能够治疗疟疾可能与结构中存在过氧键或酯基等基团有关 |
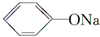 +CH3I→
+CH3I→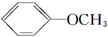 +NaI
+NaI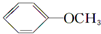 +HI→
+HI→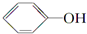 +CH3l
+CH3l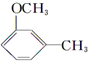 $\stackrel{KMnO_{4}(H+)}{→}$
$\stackrel{KMnO_{4}(H+)}{→}$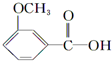
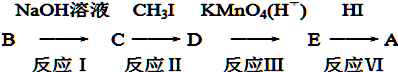
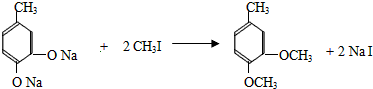 .
. .
.