��Ŀ����
20����ҵ��������������������Ҫ�ɷ�ΪFe3O4��Fe2O3��FeO��SiO2��Ϊԭ���Ʊ��ߵ�����-----���죨Fe2O3������������������ͼ��

�Իش��������⣺
��1�������ܡ�������Fe3O4������Ӧ�����ӷ�Ӧ����ʽΪFe3O4+8H+=Fe2++2Fe3++4H2O��
��2��ʵ����ʵ�֡�������з���������õIJ���������©�������������ձ��ȣ��������Ӧѡ��D�Լ�������Һ��pH������ĸ��ţ�
A��ϡ���� B������������Һ C�����������Һ D����ˮ
��3�����鲽����Ѿ�������ȫ���Լ���KSCN��Һ��
��4��������ķ�Ӧ�¶�һ���������35�����£���Ŀ���Ƿ�ֹNH4HCO3�ֽ⣬����Fe2+��ˮ�⣻
��5��������з�����Ӧ�Ļ�ѧ��Ӧ����ʽΪ4FeCO3+O2$\frac{\underline{\;����\;}}{\;}$2Fe2O3+4CO2��
��6��������У�FeCO3�ﵽ�����ܽ�ƽ��ʱ���������²����Һ��pHΪ8.5��c��Fe2+��=1��10-6 mol•L-1�����ж����õ�FeCO3���Ƿ���Fe��OH��2����ǡ�������ͨ������˵��������Һ��c��Fe2+��•c��OH-��2=1��10-6����1��10-5.5��2=1��10-17��Ksp[Fe��OH��2]=4.9��10-17������Fe��OH��2�������ɣ���֪��Ksp[Fe��OH��2]=4.9��10-17����
���� ��������Ϊ����������������Ӧ����������������Ҫ�ɷ�ΪFe3O4��Fe2O3��FeO��SiO2��������������ܣ����¶ȿ�����200��300�棩�������������������������˺�õ�������Ϊ�������裬��Һ�м���������ۣ���������������Һ������pH�����̼�������Һ��������̼���������壬��ϴ�ӡ�����ڿ���������ʱ�����ֽ⣬��������е���������������ԭ��Ӧ����������������
��1�����ܹ������������������ᷴӦ�����������ӡ������Ӻ�ˮ��
��2�����ݷ�����֪�������Ϊ���ˣ��ݴ��ж�����������������е���pHֵ���Լ�Ҫ�����ᷴӦ�Ҳ������µ����ʣ�
��3���������ܺ�KSCN��Һ��Ӧ����Ѫ��ɫ�������������������ʣ�������ǽ������ӻ�ԭ���������ӣ����鲽����Ѿ�������ȫ������Һ��û�������ӣ�
��4��������Ǽ���̼����鱗���̼��������Һ���¶ȹ�����������ˮ��̶�����ͬ��̼��������ֽ⣻
��5��������з�����ӦΪ̼�������ڿ���������������������ԭ��Ӧ���������������Ͷ�����̼��
��6��������Һ��c��Fe2+��•c��OH-��2��Ksp[Fe��OH��2]�Ƚϣ����ж�����Fe��OH��2������
��� �⣺��1����������Ϊ����������������Ӧ����������������Ҫ�ɷ�ΪFe3O4��Fe2O3��FeO��SiO2���������ᣨ���ܣ����¶ȿ�����200��300�棩�����ܹ������������������ᷴӦ�����������ӡ������Ӻ�ˮ�������ܡ�������Fe3O4������Ӧ�����ӷ���ʽΪFe3O4+8H+=Fe2++2Fe3++4H2O��
�ʴ�Ϊ��Fe3O4+8H+=Fe2++2Fe3++4H2O��
��2�����ݷ�����֪�������Ϊ���ˣ����˲������õIJ���������©�������������ձ��ȣ�������е���pHֵ���Լ�Ҫ�����ᷴӦ�Ҳ������µ����ʣ������ð�ˮ�Ϻã���ѡD��
�ʴ�Ϊ��©����D��
��3�����軯����Һ�������ӷ�Ӧ����Һ��ʾ��ɫ�����Լ�����Һ���Ƿ��������ӣ�������ǽ������ӻ�ԭ���������ӣ����鲽����Ѿ�������ȫ������Һ��û�������ӣ�������KSCN��Һ��
�ʴ�Ϊ��KSCN��Һ��
��4��������Ǽ���̼����鱗���̼��������Һ���¶ȹ�����������ˮ��̶�����ͬ��̼��������ֽ⣬�����¶�һ���������35�����£�
�ʴ�Ϊ����ֹNH4HCO3�ֽ⣬����Fe2+��ˮ�⣻
��5��������з�����ӦΪ̼�������ڿ���������������������ԭ��Ӧ������������������Ӧ����ʽΪ4FeCO3+O2$\frac{\underline{\;����\;}}{\;}$2Fe2O3+4CO2��
�ʴ�Ϊ��4FeCO3+O2$\frac{\underline{\;����\;}}{\;}$2Fe2O3+4CO2��
��6�������²����Һ��pHΪ8.5��c��OH-��=$\frac{1��1{0}^{-14}}{1{0}^{-8.5}}$=1��10-5.5�����������ݿ�֪����Һ��c��Fe2+��•c��OH-��2=1��10-6����1��10-5.5��2=1��10-17��Ksp[Fe��OH��2]=4.9��10-17������Fe��OH��2�������ɣ�
�ʴ�Ϊ������Һ��c��Fe2+��•c��OH-��2=1��10-6����1��10-5.5��2=1��10-17��Ksp[Fe��OH��2]=4.9��10-17������Fe��OH��2�������ɣ�
���� ���⿼���������仯�������ʵķ���Ӧ�ã���Ҫ�����̷�������ͷ�Ӧ���̵��жϣ���Ŀ�Ѷ��еȣ�ע���������ճ������ӵļ��鷽����ע������ܽ�ƽ���Ӧ�ã�

 ��У����ϵ�д�
��У����ϵ�д�| A�� | 2�� | B�� | 3�� | C�� | 4�� | D�� | 5�� |
| A�� | Na��H2O��Ӧ��Na+2H2O�TNa++2OH-+H2 | |
| B�� | Na�����ᷴӦ��2Na+2H+�T2Na++H2�� | |
| C�� | ��Ͷ��CuSO4��Һ�У�Cu2++2Na�TCu+2Na+ | |
| D�� | Na��O2��Ӧ��4Na+O2�T4Na++2O2- |
| A�� | ʳƷ�� | B�� | �ױ� | C�� | �� | D�� | ��ȩ |
| A�� | ̼��Ʒֽ� | B�� | ���������������Ȼ�茶��巴Ӧ | ||
| C�� | ̼�������̼��Ӧ | D�� | ����ȼ�� |
| A�� | 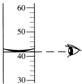 ����Һ������ | B�� | 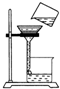 ���� | C�� |  Ϩ��ƾ��� | D�� | 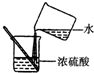 ϡ��Ũ���� |
 ��ѧ������1ͼ��ʾװ��֤����ͱ��ķ�Ӧ��ȡ����Ӧ�����Ǽӳɷ�Ӧ����Ҫʵ�鲽�����£�
��ѧ������1ͼ��ʾװ��֤����ͱ��ķ�Ӧ��ȡ����Ӧ�����Ǽӳɷ�Ӧ����Ҫʵ�鲽�����£� �����13��ԭ�ӹ�ƽ�森
�����13��ԭ�ӹ�ƽ�森