题目内容
18.下列排列有错误的是( )| A. | 粒子半径:Al3+>Mg2+>Na+>F- | B. | 碱性:Al(OH)3<Mg(OH)2<Ca(OH)2<KOH | ||
| C. | 酸性:H4SiO4<H3PO4<H2SO4<HClO4 | D. | 稳定性:HF>HCl>HBr>HI |
分析 A.电子层数相同,原子序数越小,半径越大;
B.元素的金属性越强,对应的最高价氧化物的水化物的碱性越强;
C.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
D.非金属性越强,气态氢化物越稳定.
解答 解:A.由于原子序数F<Na<Mg<Al,故半径:Al3+<Mg2+<Na+<F-,故A选;
B.元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,金属性:K>Ca>Na>Mg,则碱性:KOH>Ca(OH)2>NaOH>Mg(OH)2,能用元素周期律解释,故B不选;
C.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,非金属性:Cl>S>P>Si,则酸性:HClO4>H2SO4>H3PO4>H4SiO4,能用元素周期律解释,故C不选;
D.同主族从上到下非金属性依次减弱,则非金属性F>Cl>Br>I,所以气态氢化物的稳定性为HF>HCl>HBr>HI,故D不选,
故选A.
点评 本题考查了元素周期律的理解与应用,注意把握元素周期律的递变规律以及相关知识的积累,难度不大.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
8.下列有关化学用语或说法正确的是( )
| A. | 氯离子的结构示意图: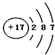 | B. | 18g18O2中含有1mol氧原子 | ||
| C. | 14N和14C是互为同位素 | D. | 氨气的电子式为: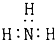 |
9.根据下列信息判断氢气燃烧生成水时的热量变化,其中一定正确的是( )


| A. | H2O分解为H2与O2时放出热量 | |
| B. | 1molH2与0.5molO2完全反应生成1mol H2O时放出热量245 kJ | |
| C. | 甲、乙、丙中物质所具有的总能量大小关系为甲>乙>丙 | |
| D. | 氢气和氧气的总能量小于水的能量 |
3.下列物质的沸点由高到低排列的是( )
①CH3(CH2)2CH3
②CH3(CH2)3CH3
③(CH3)3CH
④(CH3)2CHCH2CH3.
①CH3(CH2)2CH3
②CH3(CH2)3CH3
③(CH3)3CH
④(CH3)2CHCH2CH3.
| A. | ②④①③ | B. | ④②③① | C. | ④②①③ | D. | ②④③① |
10.有机反应从不同角度可能属于不同反应类型,下列有关有机反应类型的描述正确的是( )
| A. | 乙醇可以通过消去反应生成乙醛 | |
| B. | 乙醛可以通过加成反应生成乙酸 | |
| C. | 苯酚可以通过苯发生水解反应制取 | |
| D. | 可以通过缩聚反应制取聚对苯二甲酸乙二酯 |
7.下列离子方程式书写正确的是( )
| A. | 铁与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | Cu加到稀硫酸中:Cu+2H+═Cu2++H2↑ | |
| C. | 氯气与NaOH溶液反应:Cl2+OH-═Cl-+ClO-+H2O | |
| D. | 小苏打与NaOH溶液反应:HCO3-+OH-═CO32-+H2O |
8.下列物质中属于金属材料的是( )
| A. | 塑料 | B. | 金刚石 | C. | 玻璃 | D. | 不锈钢 |

 和
和
