题目内容
17.将某二价金属R的单质粉末投入到200mL浓度为1mol/L的H2SO4溶液中,待完全反应后滤去过量的金属粉末,蒸发溶液到剩余84g时,保持温度为t℃,开始析出RSO4•7H2O晶体.在该温度下继续蒸发,当析出20.5g晶体时,还留下49g溶液.求金属R的相对原子质量.分析 金属有剩余,则硫酸完全反应,蒸发溶液到剩余84g时,保持温度为t℃,开始析出RSO4•7H2O晶体,此时溶液为饱和溶液,在该温度下继续蒸发,当析出20.5g晶体时,还留下49g溶液,故饱和溶液质量减少为84g-49g=35g,则84g饱和溶液可以析出晶体为20.5g×$\frac{84g}{35g}$=49.2g,由硫酸根守恒n(RSO4•7H2O)=n(RSO4)=n(H2SO4),再计算晶体的相对分子质量,进而计算R的相对原子质量.
解答 解:金属有剩余,则硫酸完全反应,根据硫酸根守恒则n(RSO4)=n(H2SO4)=0.2L×1mol/L=0.2mol,蒸发溶液到剩余84g时,保持温度为t℃,开始析出RSO4•7H2O晶体,此时溶液为饱和溶液,在该温度下继续蒸发,当析出20.5g晶体时,还留下49g溶液,故饱和溶液质量减少为84g-49g=35g,则84g饱和溶液可以析出晶体为20.5g×$\frac{84g}{35g}$=49.2g,由硫酸根守恒n(RSO4•7H2O)=n(RSO4)=n(H2SO4)=0.2L×1mol/L=0.2mol,则Mr(RSO4•7H2O)=$\frac{49.2}{0.2}$=246,故Mr(R)=246-96-1×18=24,
答:R的相对分子质量为24.
点评 本题考查物质的量计算、溶解度有关计算,关键是根据饱和溶液特点计算可以得到晶体的质量.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
7.氯气常用于生活用水的杀菌,其原因是( )
| A. | 氯气有毒 | |
| B. | 氯气有刺激性气味 | |
| C. | 氯气溶于水,与水反应可生成盐酸 | |
| D. | 氯气溶于水,与水反应生成的次氯酸有强氧化性 |
8.常温下,0.1mol•L-1的下列溶液中,有关微粒的物质的量浓度关系正确的是( )
| A. | NH4Cl溶液:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | (NH4)2Fe(SO4)2溶液:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+) | |
| C. | Na2CO3溶液:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) | |
| D. | NaHCO3溶液:c(H+)+c(H2CO3)=c(OH-)+c(CO32-) |
5.相同碳原子数的烷烃、烯烃、炔烃,在空气中完全燃烧生成二氧化碳和水,所需空气量的比较中正确的是
( )
( )
| A. | 烷烃最少 | B. | 烯烃最少 | C. | 炔烃最少 | D. | 三者一样多 |
12.下列有关分子晶体熔点高低的叙述中,正确的是( )
| A. | 氯气>碘单质 | B. | 四氯化硅>四氟化硅 | ||
| C. | NH3<PH3 | D. | 异戊烷>正戊烷 |
2.下列说法正确的是( )
| A. | 乙酸与NaHCO3反应生成CO2气体,说明乙酸的酸性强于碳酸 | |
| B. | 乙烯使溴水褪色的反应方程式是:CH2=CH2+Br2→CH3CHBr2 | |
| C. | 乙烯和苯分子中都存在碳碳双键,都能发生加成反应 | |
| D. | 乙醇能发生氧化反应,乙酸不能发生氧化反应 |
9.一些中草药中常存在下列四种香豆素类化合物.下列有关它们的说法中,正确的是( )
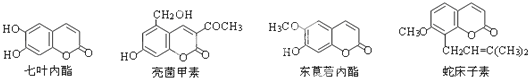
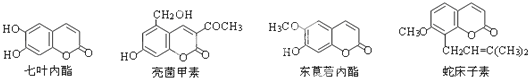
| A. | 它们均由C、H、O三种元素组成 | B. | 它们所含的官能团种类完全相同 | ||
| C. | 它们分子中均含有2个苯环 | D. | 七叶内酯与东莨菪内酯互为同系物 |
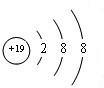 ,C原子的结构示意图为
,C原子的结构示意图为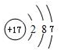 .
. .
.