题目内容
14.下列有关金属腐蚀与防护的叙述不正确的是( )| A. | 吸氧腐蚀比析氢腐蚀更加普遍,因为吸氧腐蚀的速度比析氢腐蚀快 | |
| B. | 铁闸门与直流电源正极相连从而防止闸门腐蚀的方法称为外接直流电源的阴极保护法 | |
| C. | 金属的电化学腐蚀比化学腐蚀更普通 | |
| D. | 用原电池的原理保护金属的方法称为牺牲阳极的阴极保护法 |
分析 A.金属的腐蚀主要是吸氧腐蚀,是因为一般情况金属接触的电解质溶液呈中性或弱酸性;
B.电解池的正极(活泼金属)容易被腐蚀,阴极才被保护;
C.金属的腐蚀以电化学腐蚀为主;
D.原电池中被保护的金属做正极则不会被腐蚀.
解答 解:A.在酸性较强的溶液中金属发生电化学腐蚀时放出氢气,称为析氢腐蚀,一般情况金属接触的电解质溶液呈中性或弱酸性,发生吸氧腐蚀更加普通,故A错误;
B.将钢闸门与直流电源的正极相连,钢闸作阳极,活泼金属铁作阳极,容易失去电子而被腐蚀,所以将钢闸门与直流电源的正极相连不能防止其被腐蚀,反而能加快被腐蚀,故B错误;
C.金属的腐蚀以电化学腐蚀为主,电化学腐蚀比化学腐蚀更普遍,故C正确;
D.原电池中被保护的金属做正极则不会被腐蚀,称为牺牲阳极的阴极保护法,故D正确;
故选AB.
点评 本题考查了金属的腐蚀与防护,题目难度中等,注意掌握金属的电化学腐蚀原理,明确金属防护常用的措施及原理,能够正确辩别电化学腐蚀与化学腐蚀的、析氢腐蚀与吸氧腐蚀.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.菠萝酯常用作化妆品香料,其合成方法如下,下列说法正确的是( )


| A. | 菠萝酯不存在顺反异构现象 | B. | 原料中最多5个原子共线 | ||
| C. | 菠萝酯中所有的原子都可能共平面 | D. | 中间体和菠萝酯中均含手性碳原子 |
5.“神舟”七号所用动力燃料之一为LiH,已知下列反应:
①2Li(s)+H2(g)═2LiH(s)△H1=-182kJ•mol-1;
②2H2(g)+O2(g)═2H2O(l)△H2=-572kJ•mol-1;
③4Li(s)+O2(g)═2Li2O(s)△H3=-1 196kJ•mol-1.
则LiH在O2中燃烧的热化学方程式为( )
①2Li(s)+H2(g)═2LiH(s)△H1=-182kJ•mol-1;
②2H2(g)+O2(g)═2H2O(l)△H2=-572kJ•mol-1;
③4Li(s)+O2(g)═2Li2O(s)△H3=-1 196kJ•mol-1.
则LiH在O2中燃烧的热化学方程式为( )
| A. | 2LiH(s)+O2(g)═Li2O(s)+H2O(l)△H=-702 kJ•mol-1 | |
| B. | 2LiH(s)+O2(g)═Li2O(s)+H2O(l)△H=-1 950 kJ•mol-1 | |
| C. | 2LiH(s)+O2(g)═Li2O(s)+H2O(l)△H=-1 586 kJ•mol-1 | |
| D. | 2LiH(s)+O2(g)═Li2O(s)+H2O(g)△H=-988 kJ•mol-1 |
2.下列实验目的可以达到的是( )
| A. | 漂白粉与浓盐酸反应可制取氯气 | |
| B. | 用FeS与稀硝酸制取硫化氢 | |
| C. | 浓硫酸与碘化钠共热制取碘化氢 | |
| D. | 用浓溴水除去苯中溶有的少量的苯酚 |
19.某元素的原子,L层电子数是M层电子数的2倍,该元素是( )
| A. | Mg | B. | C | C. | Si | D. | S |
3.从柑桔中炼制萜二烯 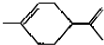 ,下列有关它的推测不正确的是( )
,下列有关它的推测不正确的是( )
 ,下列有关它的推测不正确的是( )
,下列有关它的推测不正确的是( )| A. | 能使酸性高锰酸钾溶液褪色 | |
| B. | 常温下为气态,难溶于水 | |
| C. | 分子式为C10H16 | |
| D. | 与过量的溴的CCl4溶液反应后产物为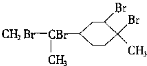 |
4.下列实验能获得成功的是( )
| A. | 苯与浓溴水反应制溴苯 | |
| B. | 在浓溴水中加几滴苯酚观察到白色沉淀 | |
| C. | 将乙醛滴入银氨溶液中制银镜 | |
| D. | 1mol/L CuSO4溶液2mL和0.5mol/L NaOH溶液4mL混合后加入40%乙醛溶液0.5mL,加热煮沸观察沉淀颜色 |
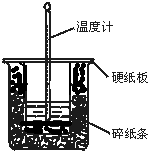 50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: