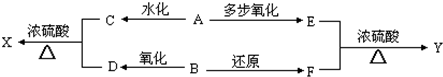
题目内容
5.“神舟”七号所用动力燃料之一为LiH,已知下列反应:①2Li(s)+H2(g)═2LiH(s)△H1=-182kJ•mol-1;
②2H2(g)+O2(g)═2H2O(l)△H2=-572kJ•mol-1;
③4Li(s)+O2(g)═2Li2O(s)△H3=-1 196kJ•mol-1.
则LiH在O2中燃烧的热化学方程式为( )
| A. | 2LiH(s)+O2(g)═Li2O(s)+H2O(l)△H=-702 kJ•mol-1 | |
| B. | 2LiH(s)+O2(g)═Li2O(s)+H2O(l)△H=-1 950 kJ•mol-1 | |
| C. | 2LiH(s)+O2(g)═Li2O(s)+H2O(l)△H=-1 586 kJ•mol-1 | |
| D. | 2LiH(s)+O2(g)═Li2O(s)+H2O(g)△H=-988 kJ•mol-1 |
分析 根据盖斯定律,将已知热化学方程式$\frac{1}{2}$(④+③)-①可得目标热化学方程式:2LiH(s)+O2(g)═Li2O(s)+H2O(l),据此计算出该反应的焓变即可.
解答 解:①2Li(s)+H2(g)═2LiH(s)△H1=-182kJ•mol-1;
②2H2(g)+O2(g)═2H2O(l)△H2=-572kJ•mol-1;
③4Li(s)+O2(g)═2Li2O(s)△H3=-1196kJ•mol-1,
根据盖斯定律,$\frac{1}{2}$(④+③)-①可得:2LiH(s)+O2(g)═Li2O(s)+H2O(l)△H=$\frac{1}{2}$[-1196kJ•mol-1)+(-572kJ•mol-1)]-(-182kJ•mol-1)=-702 kJ•mol-1,
故选A.
点评 本题考查了热化学方程式的书写方法,题目难度不大,明确盖斯定律的内容及应用方法为解答关键,注意熟练掌握热化学方程式的书写原则,试题侧重考查学生的分析能力及灵活应用基础知识的能力.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
4.用系统命名法命名有机物 ,正确的是( )
,正确的是( )
 ,正确的是( )
,正确的是( )| A. | 3,3-二甲基-2-乙基戊烷 | B. | 3,3,4-三甲基己烷 | ||
| C. | 2-乙基-3,3-二甲基戊烷 | D. | 3,4,4-三甲基己烷 |
5.把0.1mol KOH固体分别加入到下列100mL的溶液中,溶液的导电能力无变化的是( )
| A. | 纯净水 | B. | 0.1mol•L-1HCl | ||
| C. | 1.0mol•L-1CH3COOH | D. | 0.5mol•L-1H2SO4 |
13.有机物的种类繁多,但其命名是有规则的.下列有机物命名正确的是( )
| A. | 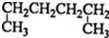 1,4-二甲基丁烷 1,4-二甲基丁烷 | B. | 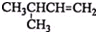 3-甲基丁烯 3-甲基丁烯 | ||
| C. | 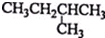 2-甲基丁烷 2-甲基丁烷 | D. | CH2Cl-CH2Cl 二氯乙烷 |
20.下列关于热化学反应的描述中正确的是( )
| A. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和NaOH完全反应的中和热为-114.6kJ/mol | |
| B. | CO(g)的燃烧热是283.0kJ/mol,则表示CO燃烧热的热化学方程式为2CO(g)+O2(g)═2CO2(g);△H=-283.0kJ/mol | |
| C. | 一个化学反应的热效应,只与反应的始态与终态有关,与反应的过程无关 | |
| D. | 需要加热才能发生的反应一定是吸热反应 |
10.CH3CH(CH3)CH(CH3)CH2CH3的名称是( )
| A. | 1,3?二甲基戊烷 | B. | 2?甲基??3 乙基丁烷 | ||
| C. | 3,4?二甲戊烷 | D. | 2,3?二甲基戊烷 |
14.下列有关金属腐蚀与防护的叙述不正确的是( )
| A. | 吸氧腐蚀比析氢腐蚀更加普遍,因为吸氧腐蚀的速度比析氢腐蚀快 | |
| B. | 铁闸门与直流电源正极相连从而防止闸门腐蚀的方法称为外接直流电源的阴极保护法 | |
| C. | 金属的电化学腐蚀比化学腐蚀更普通 | |
| D. | 用原电池的原理保护金属的方法称为牺牲阳极的阴极保护法 |
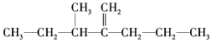 的系统命名为:3-甲基-2-丙基-1-戊烯
的系统命名为:3-甲基-2-丙基-1-戊烯 ③?H COOH、④CH3COOC2H5.
③?H COOH、④CH3COOC2H5. ;②CH2=CH2;③CH≡CH;④
;②CH2=CH2;③CH≡CH;④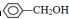 ;⑤
;⑤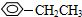 ;
;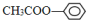 ;⑦CH3CH2CH2CH2Br中能与NaOH溶液反应,但不能与Na2CO3溶液反应的是⑥⑦. (填写上述物质的序号)
;⑦CH3CH2CH2CH2Br中能与NaOH溶液反应,但不能与Na2CO3溶液反应的是⑥⑦. (填写上述物质的序号)