题目内容
3.氯气和二氧化硫皆可作漂白剂.若同时使用于漂白一种物件时,其漂白效果是( )| A. | 增强 | B. | 减弱 | C. | 不变 | D. | 不能确定 |
分析 氯气具有强氧化性,二氧化硫具有还原性,在水溶液中发生氧化还原反应生成硫酸和盐酸,据此分析.
解答 解:氯水和SO2皆可作漂白剂,若同时使用于漂白一种物质时,因为氯气具有强氧化性,二氧化硫具有还原性,在水溶液中发生氧化还原反应生成硫酸和盐酸,反应的化学方程式为SO2+Cl2+2H2O=2HCl+H2SO4,漂白效果减弱.
故选B.
点评 本题考查了元素化合物的性质,题目难度不大,明确氯气、二氧化硫的性质是解题的关键,侧重于考查学生的分析能力和应用能力.

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
13.现有25mL 2mol•L-1的Na2CO3溶液和75mL 1mol•L-1的稀盐酸.①将Na2CO3溶液逐滴滴加到盐酸中;②将盐酸逐滴滴加到Na2CO3溶液中.在标准状况下生成气体的情况是( )
| A. | 均为0.84 L | B. | 均为0.56 L | C. | ①>② | D. | ①<② |
14.下列物质用途不正确的是( )
| A. | 重晶石可作钡餐与白色颜料 | |
| B. | 硫酸是重要的化工原料之一,可用来制造磷肥 | |
| C. | 明矾常用作消毒剂 | |
| D. | 胆矾可用于配置波尔多液 |
18.设NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 23gNO2和N2O4的混合气体中含原子总数为1.5NA | |
| B. | 31g白磷P4(如图)中所含的P-P键的个数为0.25NA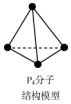 | |
| C. | 足量的Cu与100mL18.4mol/L的浓硫酸反应,失去3.68NA个电子 | |
| D. | 浓度均为2.0mol/L的盐酸和醋酸溶液各100mL,其含氢离子均为0.2NA |
8.下列对硫酸的叙述正确的是( )
| A. | 因浓硫酸具有强氧化性,故不可用它来干燥氢气 | |
| B. | 浓硫酸可用铁铝容器存放是因为常温下浓硫酸不与这两种金属反应 | |
| C. | 浓硫酸有强氧化性,稀硫酸不具有氧化性 | |
| D. | 实验室中利用浓硫酸的高沸点性来制备HCl等气体 |
15. 如图装置实验,一段时间后某同学记录如下:
如图装置实验,一段时间后某同学记录如下:
①Zn为正极,Cu为负极 ②屯解质溶液pH不变
③电子流动的方向为:Zn→Cu ④Cu极上有氢气产生
⑤若有1mol电子流过导线,则产生氢气11.2L.
上述记录中描述正确的是( )
 如图装置实验,一段时间后某同学记录如下:
如图装置实验,一段时间后某同学记录如下:①Zn为正极,Cu为负极 ②屯解质溶液pH不变
③电子流动的方向为:Zn→Cu ④Cu极上有氢气产生
⑤若有1mol电子流过导线,则产生氢气11.2L.
上述记录中描述正确的是( )
| A. | ③④⑤ | B. | ③④ | C. | ①②③ | D. | ②④⑤ |
12.除去NaCl固体中的NH4Cl杂质的最佳方法是( )
| A. | 结晶法 | B. | 加入烧碱溶液 | C. | 加热法 | D. | 加入AgNO3溶液 |
7.在足量NaI溶液中,加入少量氯水及四氯化碳,振荡后静置,出现的现象( )
| A. | 溶液不分层,溶液呈紫红色 | B. | 溶液分两层,上层液体呈紫红色 | ||
| C. | 溶液分两层,下层液体呈紫红色 | D. | 溶液分两层,下层是无色液体 |
 氮及其化合物在工农业生产中具有重要作用.
氮及其化合物在工农业生产中具有重要作用.