题目内容
18.设NA代表阿伏加德罗常数,下列说法正确的是( )| A. | 23gNO2和N2O4的混合气体中含原子总数为1.5NA | |
| B. | 31g白磷P4(如图)中所含的P-P键的个数为0.25NA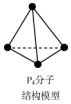 | |
| C. | 足量的Cu与100mL18.4mol/L的浓硫酸反应,失去3.68NA个电子 | |
| D. | 浓度均为2.0mol/L的盐酸和醋酸溶液各100mL,其含氢离子均为0.2NA |
分析 A.NO2和N2O4的最简式为NO2,根据最简式计算混合物中含有原子总数;
B. 分子中含有6个P-P键,根据n=$\frac{m}{M}$计算出P4的物质的量,然后计算出含有P-P键数目;
分子中含有6个P-P键,根据n=$\frac{m}{M}$计算出P4的物质的量,然后计算出含有P-P键数目;
C.铜足量,稀硫酸不与铜反应,则转移电子的数目减少;
D.醋酸为弱酸,在溶液中部分电离.
解答 解:A.23gNO2和N2O4的混合气体中含23g最简式为NO2,含有最简式NO2的物质的量为:$\frac{23g}{46g/mol}$=0.5mol,含有原子的物质的量为:0.5mol×3=1.5mol,则该混合物中含有原子总数为1.5NA,故A正确;
B.根据 可知,1mol白磷中有6molP-P,31g白磷中P4物质的量为:$\frac{31g}{31g/mol×4}$=0.25mol,含有P-P的物质的量为:0.25mol×6=1.5mol,所含的P-P键的个数为1.5NA;故B错误;
可知,1mol白磷中有6molP-P,31g白磷中P4物质的量为:$\frac{31g}{31g/mol×4}$=0.25mol,含有P-P的物质的量为:0.25mol×6=1.5mol,所含的P-P键的个数为1.5NA;故B错误;
C.足量的Cu与100mL18.4mol/L的浓硫酸反应,浓硫酸变成稀硫酸后反应停止,则反应失去电子的数目小于3.68NA,故C错误;
D.100mL 2.0mol/L的盐酸中含有HCl的物质的量为0.2mol,HCl为强电解质,完全电离,则盐酸中氢离子的物质的量为0.2mol,而醋酸为弱酸,只能部分电离,则醋酸中氢离子的物质的量小于0.2mol,故D错误;
故选A.
点评 本题考查阿伏加德罗常数的应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
8.在给定条件下,下列选项中所示的物质间转化能够一步实现的是( )
| A. | NH3$→_{催化剂△}^{O_{2}}$NO2$\stackrel{H_{2}O_{2}(aq)}{→}$HNO3 | |
| B. | 含2molHCl的浓盐酸$→_{△}^{总量MnO_{2}}$0.5molCl2$\stackrel{石灰石}{→}$0.25molCa(ClO)2 | |
| C. | 饱和NaCl溶液$\stackrel{NH_{3}.CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| D. | 海水$\stackrel{熟石灰}{→}$Mg(OH)2$\stackrel{稀盐酸}{→}$MgCl2(aq)$\stackrel{通电}{→}$Mg |
9.人类生活需要能量,下列能量是由化学变化引起的是( )
| A. | 电灯通电发出光 | B. | 水力发电产生电能 | ||
| C. | 液化石油气燃烧放出热量 | D. | 电熨斗通电发出热量 |
6.常温下,将100mL0.05mol/L氢硫酸中逐渐通入氯气,下列叙述正确的是( )
| A. | 溶液pH先变大后变小 | B. | 溶液导电能力逐渐增强 | ||
| C. | 氢硫酸完全反应生成1.6g硫 | D. | 这个反应可以证明还原性Cl->S2- |
3.氯气和二氧化硫皆可作漂白剂.若同时使用于漂白一种物件时,其漂白效果是( )
| A. | 增强 | B. | 减弱 | C. | 不变 | D. | 不能确定 |
10.在体积为V的密闭容器中,能入amolNO、bmolO2、cmolN2,充分反应后,容器内氮原子数和氧原子数之比为( )
| A. | $\frac{(a+c)}{(a+b)}$ | B. | $\frac{(a+2c)}{(a+b+c)}$ | C. | $\frac{2(a+c)}{(a+2b+c)}$ | D. | $\frac{(a+2c)}{(a+2b)}$ |
7.硒(Se)的最外层电子数为6,比S多一个电子层,则下列关于硒的叙述不正确的是( )
| A. | 质子数为24 | B. | 气态氢化物为H2Se | ||
| C. | 非金属性比溴弱 | D. | 最高价含氧酸为H2SeO4 |
2.存在氯离子的物质的是( )
| A. | 氯化氢气体 | B. | 氯气 | C. | 盐酸 | D. | 液态氯化氢 |
 ,水溶液是弱(填“强、弱”)酸,写出氢硫酸的电离方程式H2S?HS-+H+.其水溶液在空气中放置一段时间后会出现淡黄色的S沉淀现象,该反应的化学方程式是2H2S+O2=2S+2H2O,所以硫化氢水溶液不能长期放置.盛放硫化氢水溶液的试剂瓶壁上常有一些固体,可用CS2(填化学式)洗涤除去.
,水溶液是弱(填“强、弱”)酸,写出氢硫酸的电离方程式H2S?HS-+H+.其水溶液在空气中放置一段时间后会出现淡黄色的S沉淀现象,该反应的化学方程式是2H2S+O2=2S+2H2O,所以硫化氢水溶液不能长期放置.盛放硫化氢水溶液的试剂瓶壁上常有一些固体,可用CS2(填化学式)洗涤除去.